Ingredientes activos: Darbepoetin alfa
Aranesp 10 microgramos solución inyectable en jeringa precargada.
Aranesp 15 microgramos solución inyectable en jeringa precargada.
Aranesp 20 microgramos solución inyectable en jeringa precargada.
Aranesp 30 microgramos solución inyectable en jeringa precargada.
Aranesp 40 microgramos solución inyectable en jeringa precargada.
Aranesp 50 microgramos solución inyectable en jeringa precargada.
Aranesp 60 microgramos solución inyectable en jeringa precargada.
Aranesp 80 microgramos solución inyectable en jeringa precargada.
Aranesp 100 microgramos solución inyectable en jeringa precargada.
Aranesp 130 microgramos solución inyectable en jeringa precargada.
Aranesp 150 microgramos solución inyectable en jeringa precargada.
Aranesp 300 microgramos solución inyectable en jeringa precargada.
Aranesp 500 microgramos solución inyectable en jeringa precargada.
Los prospectos de Aranesp están disponibles para los siguientes tamaños de envase: - Aranesp 10 microgramos solución inyectable en jeringa precargada, Aranesp 15 microgramos solución inyectable en jeringa precargada, Aranesp 20 microgramos solución inyectable en jeringa precargada, Aranesp 30 microgramos solución inyectable en jeringa precargada, Aranesp 40 microgramos solución inyectable en 50 microgramos solución inyectable, Aranesp 40 microgramos solución inyectable en 50 microgramos solución inyectable en jeringa precargada, Aranesp 60 microgramos solución inyectable en jeringa precargada, Aranesp 80 microgramos solución inyectable en jeringa precargada jeringa llena, Aranesp 100 microgramos solución inyectable en jeringa precargada, Aranesp 130 microgramos solución inyectable en jeringa precargada, Aranesp 150 microgramos solución inyectable en jeringa precargada, Aranesp 150 microgramos solución inyectable en jeringa precargada , Aranesp 150 microgramos solución inyectable en jeringa precargada 300 microgramos solución inyectable en jeringa precargada, Aranesp 500 microgramos solución inyectable en jeringa precargada
- Aranesp 10 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 15 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 20 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 30 microgramos solución para inyección en pluma precargada (SureClick), Aranesp 40 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 50 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 60 microgramos solución inyectable en pluma precargada pen (SureClick), Aranesp 80 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 100 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 130 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 150 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 300 microgramos solución inyectable en pluma precargada (SureClick), Aranesp 500 microgramos solución inyectable en pluma precargada (SureClick
- Aranesp 25 microgramos solución inyectable en vial, Aranesp 40 microgramos solución inyectable en vial, Aranesp 60 microgramos solución inyectable en vial, Aranesp 100 microgramos solución inyectable en vial, Aranesp 200 microgramos solución inyectable en vial, Aranesp 300 microgramos solución para inyección en vial
¿Por qué se usa Aranesp? ¿Para qué sirve?
El médico le recetó Aranesp (un antianémico) para tratar su anemia. Sufre de anemia cuando no hay una cantidad suficiente de glóbulos rojos en la sangre y los síntomas de la anemia pueden ser agotamiento, debilidad y dificultad para respirar.
Aranesp actúa exactamente de la misma manera que la hormona natural eritropoyetina, que es producida por los riñones y estimula la médula ósea para que produzca más glóbulos rojos. El principio activo de Aranesp es darbepoetin alfa, que se produce mediante ingeniería genética en células de ovario de hámster chino (CHO-K1).
Si padece insuficiencia renal crónica.
Aranesp se utiliza para tratar la anemia sintomática asociada con insuficiencia renal crónica en adultos y niños. En la insuficiencia renal, los riñones no producen suficiente hormona natural eritropoyetina que a menudo puede causar anemia.
A su cuerpo le tomará algún tiempo producir más glóbulos rojos y luego le tomará alrededor de cuatro semanas antes de que note algún efecto.La capacidad de Aranesp para tratar la anemia no se verá afectada por la práctica normal de diálisis.
Si está recibiendo quimioterapia
Aranesp se utiliza en el tratamiento de la anemia sintomática en pacientes adultos con tumores distintos de la médula ósea (neoplasias malignas no mieloides) que reciben quimioterapia.
Uno de los principales efectos secundarios de la quimioterapia es que evita que la médula ósea produzca suficientes células sanguíneas. Hacia el final de su tratamiento de quimioterapia, particularmente si ha recibido mucha quimioterapia, su recuento de glóbulos rojos puede disminuir, provocando anemia.
Contraindicaciones Cuándo no se debe utilizar Aranesp
No use Aranesp
- si es alérgico a darbepoetin alfa oa cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si le han diagnosticado presión arterial alta que actualmente no se controla con otros medicamentos recetados por su médico
Precauciones de uso Lo que necesita saber antes de tomar Aranesp
Hable con su médico, farmacéutico o enfermero antes de usar Aranesp.
Informe a su médico si tiene o ha padecido:
- presión arterial alta que actualmente se controla con medicamentos recetados por un médico;
- anemia falciforme;
- ataques (convulsiones);
- convulsiones (ataques o ataques);
- enfermedad del higado;
- falta significativa de respuesta a los medicamentos utilizados para tratar la anemia;
- alergia al látex (el capuchón de la aguja de la jeringa precargada contiene un derivado del látex); o
- hepatitis C.
Advertencias especiales:
- Si experimenta síntomas que incluyen cansancio inusual y pérdida de fuerza, es posible que tenga aplasia pura de glóbulos rojos (PRCA) que se ha informado en pacientes. PRCA significa que el cuerpo deja de producir o reduce la producción de glóbulos rojos, lo que causa anemia severa. Si experimenta estos síntomas, debe informar a su médico, quien decidirá la mejor estrategia de tratamiento de la anemia.
- Tenga especial cuidado al tomar otros medicamentos que estimulan la producción de glóbulos rojos: Aranesp pertenece a un grupo de productos que estimulan la producción de glóbulos rojos y eritropoyetina humana. Su profesional de la salud siempre debe registrar el nombre correcto del medicamento que está tomando.
- Su médico debe tratar de mantener su hemoglobina entre 10 y 12 g / dl. Su médico comprobará que su nivel de hemoglobina no exceda un nivel específico, ya que los niveles altos de hemoglobina podrían ponerlo en riesgo de tener problemas cardíacos o vasculares y podrían aumentar la riesgos de infarto de miocardio, accidente cerebrovascular y muerte.
- Si tiene insuficiencia renal crónica, existe un mayor riesgo de problemas cardíacos o vasculares graves (eventos cardiovasculares) si la hemoglobina se mantiene demasiado alta.
- Si tiene síntomas que incluyen dolor de cabeza intenso, somnolencia, confusión, problemas de visión, náuseas, vómitos o convulsiones, podría significar que tiene presión arterial muy alta. Si experimenta estos síntomas, debe comunicarse con su médico.
- Si tiene cáncer, debe saber que Aranesp puede actuar como factor de crecimiento de las células sanguíneas y que, en algunas circunstancias, puede tener efectos negativos sobre el cáncer. Dependiendo de la situación específica, puede ser preferible una transfusión de sangre. Discuta esto con su médico.
- El uso inadecuado por parte de sujetos sanos puede provocar problemas cardíacos y vasculares que pongan al sujeto en peligro inmediato de vida.
Interacciones ¿Qué medicamentos o alimentos pueden cambiar el efecto de Aranesp?
Otros medicamentos y Aranesp
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría utilizar cualquier otro medicamento.
Los medicamentos ciclosporina y tacrolimus (medicamentos que inhiben el sistema inmunológico) pueden verse afectados por el número de glóbulos rojos. Es importante que informe a su médico si está tomando alguno de estos medicamentos.
Toma de Aranesp con alimentos y bebidas
Los alimentos y bebidas no afectan a Aranesp.
Advertencias Es importante saber que:
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Aranesp no se ha probado en mujeres embarazadas. Es importante informar a su médico si:
- está embarazada
- cree que puede estar embarazada; o
- está planeando un embarazo.
Se desconoce si darbepoetin alfa se excreta en la leche materna. Si usa Aranesp debe dejar de amamantar.
Conducción y uso de máquinas
No se espera que Aranesp limite la capacidad para conducir o utilizar máquinas.
Aranesp contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, esencialmente exento de sodio.
Dosis, método y momento de administración Cómo utilizar Aranesp: Posología
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte a su médico o farmacéutico.
Basándose en algunos análisis de sangre, su médico ha determinado que necesita Aranesp ya que su nivel de hemoglobina es de 10 g / dl o menos. Su médico le dirá cuánto y con qué frecuencia se administra Aranesp para mantener un nivel de hemoglobina entre 10 y 12 g / dl. Puede variar según se trate de un adulto o un niño.
Cómo inyectarse Aranesp
Su médico puede decidir que es mejor para usted o su cuidador inyectarse Aranesp. Su médico, enfermera o farmacéutico le mostrará cómo inyectarse usted mismo con la jeringa precargada. No intente inyectarse usted mismo si no le han dicho cómo hacerlo. Nunca se inyecte Aranesp en una vena.
Si padece insuficiencia renal crónica.
Para todos los pacientes adultos y pediátricos ≥ 11 años de edad con insuficiencia renal crónica, Aranesp se administra como una única inyección debajo de la piel (subcutánea) o en una vena (intravenosa).
La dosis inicial de Aranesp por kilogramo de peso corporal para corregir la anemia será:
- 0,75 microgramos una vez cada dos semanas, o
- 0,45 microgramos una vez a la semana.
Para pacientes adultos que no están en diálisis, también se pueden usar 1,5 microgramos / kg una vez al mes como dosis inicial.
Todos los pacientes adultos y pediátricos de ≥ 11 años con insuficiencia renal crónica, una vez que se haya corregido su anemia, seguirán recibiendo Aranesp en una sola inyección, ya sea una vez a la semana o una vez cada dos semanas. Si no está en diálisis, Aranesp podría también se debe administrar en forma de inyección una vez al mes.
Su médico tendrá análisis de sangre periódicos para comprobar cómo está respondiendo su anemia y puede ajustar su dosis una vez cada cuatro semanas según sea necesario.
Una vez que se corrija su anemia, su médico continuará haciéndose análisis de sangre regulares y la dosis aún se puede ajustar para mantener el control a largo plazo de la anemia. Su médico le informará si cambiará la dosis.
También se controlará su presión arterial con regularidad, especialmente al inicio del tratamiento.
En algunos casos, su médico puede sugerirle que tome suplementos de hierro.
Su médico puede decidir cambiar la forma en que se administra la inyección (ya sea debajo de la piel o en una vena). Si cambia la forma en que se administra, comenzará con la misma dosis que recibió antes y su médico le hará algunas pruebas. análisis de sangre para garantizar que la anemia siempre se trate correctamente.
Si su médico ha decidido cambiar su tratamiento de r-HuEPO (eritropoyetina producida por tecnología genética) a Aranesp, también decidirá con qué frecuencia debe administrarse Aranesp una vez a la semana o una vez cada dos semanas. para r-HuEPO, pero su médico le dirá cuánto tomar y cuándo, y puede ajustar la dosis si es necesario.
Si está recibiendo quimioterapia
Aranesp se administra una vez a la semana o una vez cada tres semanas como una única inyección debajo de la piel.
La dosis inicial para corregir la anemia será:
- 500 microgramos una vez cada tres semanas (6,75 microgramos de Aranesp por kilogramo de peso corporal), o
- 2,25 microgramos (una vez a la semana) de Aranesp por kilogramo de peso corporal.
Su médico le realizará análisis de sangre periódicos para comprobar cómo está respondiendo su anemia y puede ajustar la dosis según sea necesario. El tratamiento continuará durante unas cuatro semanas después de que finalice el ciclo de quimioterapia. Su médico le indicará exactamente cuándo dejar de tomarla. Aranesp.
En algunos casos, su médico puede sugerirle que tome suplementos de hierro.
Instrucciones para inyectarse usted mismo con la jeringa precargada de Aranesp
Esta sección contiene información sobre cómo inyectarse Aranesp usted mismo. Es importante que no intente inyectarse usted mismo si su médico, enfermero o farmacéutico no le han dicho cómo inyectarse. Si tiene alguna pregunta sobre cómo inyectarse, pregunte su médico, enfermera o farmacéutico para obtener ayuda.
Cómo usar Aranesp en una jeringa precargada por usted o la persona que le administra la inyección
Su médico le ha recetado Aranesp en una jeringa precargada para inyección en el tejido que se encuentra inmediatamente debajo de la piel. Su médico, enfermera o farmacéutico le dirá la cantidad de Aranesp que necesita y la frecuencia con la que debe inyectarse.
Qué se necesita:
Para administrarse una inyección, necesitará:
- una nueva jeringa precargada de Aranesp; Y
- toallitas con alcohol o desinfectantes similares.
¿Qué debo hacer antes de administrarme una "inyección subcutánea de Aranesp"?
- Saque la jeringa precargada de la nevera. Deje la jeringa precargada a temperatura ambiente durante unos 30 minutos. Esto hará que la inyección sea más cómoda. No caliente Aranesp de ninguna otra manera (como en un horno microondas o en agua caliente). Además, no deje la jeringa a la luz solar directa.
- No agite la jeringa precargada.
- No retire el capuchón de la aguja de la jeringa hasta que esté listo para inyectarse.
- Compruebe que la dosis sea la exacta recetada por su médico.
- Compruebe la fecha de caducidad en la etiqueta de la jeringa precargada (EXP). No la utilice si es posterior al último día del mes indicado.
- Compruebe el aspecto de Aranesp. Debe ser un líquido transparente, incoloro o ligeramente opalescente. Si está turbio o ve partículas, no debe utilizarlo.
- Lávese bien las manos.
- Encuentre una superficie cómoda, bien iluminada y limpia y tenga todo lo que necesita a mano.
¿Cómo preparo la inyección de Aranesp?
Antes de inyectarse Aranesp debe hacer lo siguiente: 1. Para evitar doblar la aguja, retire suavemente el capuchón de la aguja sin girarlo como se muestra en las figuras 1 y 2. 2. No toque la aguja y no presione el émbolo. 3. Puede notar una pequeña burbuja de aire en la jeringa precargada. No debe quitar la burbuja de aire antes de inyectar. Inyectar la solución con la burbuja de aire es inofensivo. 4. Ahora puede usar la jeringa precargada.
¿Dónde debo ponerme la inyección?
Los mejores lugares para inyectarse son la parte superior de los muslos y el abdomen. Si otra persona le aplica la inyección, también puede usar la parte posterior de los brazos.
Cambie el lugar de la inyección si nota que el área está enrojecida o adolorida.
¿Cómo me pongo la inyección?
- Desinfecte la piel con la toallita con alcohol y levante la piel entre el pulgar y el índice (sin apretarla).
- Introduzca la aguja completamente en su piel como le indique su médico, enfermero o farmacéutico.
- Inyecte la dosis prescrita por vía subcutánea según las indicaciones de su médico, enfermera o farmacéutico.
- Empuje el émbolo con una presión lenta y constante, manteniendo siempre la piel pellizcada, hasta que la jeringa esté vacía.
- Saque la aguja y suelte la piel.
- Si nota una mancha de sangre, puede presionar suavemente una bola de algodón o una gasa en el lugar de la inyección. No frote el lugar de la inyección. Si es necesario, puede cubrir el lugar de la inyección con una tirita adhesiva.
- Utilice cada jeringa para una sola inyección. No reutilice el Aranesp sobrante en la jeringa.
Recuerde: si tiene algún problema, no dude en consultar a su médico o enfermero para obtener ayuda o consejo.
Eliminación de jeringas usadas
- No vuelva a poner la tapa en las agujas usadas, ya que podría pincharse accidentalmente.
- Mantenga las jeringas usadas fuera de la vista y del alcance de los niños.
- Las jeringas precargadas usadas deben desecharse de acuerdo con los requisitos locales. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. Esto ayudará a proteger el medio ambiente.
Sobredosis Qué hacer si ha tomado demasiado Aranesp
Si usa más Aranesp del que debiera
Puede tener problemas graves si toma más Aranesp del que necesita, como presión arterial muy alta. Si esto sucede, debe comunicarse con su médico, enfermera o farmacéutico. Si no se siente bien, comuníquese con su médico, enfermera o farmacéutico inmediatamente.
Si olvidó usar Aranesp
No tome una dosis doble para compensar las dosis olvidadas.
Si olvidó una dosis de Aranesp, debe ponerse en contacto con su médico para saber cuándo debe recibir su próxima inyección.
Si deja de tomar Aranesp
Si desea dejar de usar Aranesp, debe consultarlo primero con su médico.
Efectos secundarios ¿Cuáles son los efectos secundarios de Aranesp?
Como todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Tras la administración de Aranesp, algunos pacientes experimentaron los siguientes efectos secundarios:
Pacientes con insuficiencia renal crónica
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas.
- Presión arterial alta (hipertensión)
- Reacciones alérgicas
Frecuentes: pueden afectar hasta 1 de cada 10 personas.
- Carrera
- Dolor en el lugar de la inyección.
- Erupciones cutáneas y / o enrojecimiento de la piel.
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas.
- Coágulos de sangre (trombosis)
- Convulsiones (convulsiones)
Frecuencia no conocida: la frecuencia no puede estimarse a partir de los datos disponibles.
- Aplasia pura de glóbulos rojos (PRCA) - (anemia, cansancio inusual, pérdida de fuerza)
Pacientes con cáncer
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas.
- Reacciones alérgicas
- Retención de líquidos (edema)
Frecuentes: pueden afectar hasta 1 de cada 10 personas.
- Presión arterial alta (hipertensión)
- Coágulos de sangre (trombosis)
- Dolor en el lugar de la inyección.
- Erupciones cutáneas y / o enrojecimiento de la piel.
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas.
- Convulsiones (convulsiones)
Todos los pacientes
Frecuencia no conocida: la frecuencia no puede estimarse a partir de los datos disponibles.
Reacciones alérgicas graves que pueden incluir:
- Reacciones alérgicas repentinas que pueden ser fatales (anafilaxia).
- Hinchazón de la cara, labios, boca, lengua o garganta que puede dificultar la deglución o la respiración (angioedema).
- Dificultad para respirar (broncoespasmo alérgico)
- Erupciones en la piel
- Urticaria (urticaria)
Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluidos los posibles efectos adversos que no aparecen en este prospecto.
Caducidad y retención
Mantenga este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta de la jeringa precargada después de CAD. La fecha de caducidad se refiere al último día de ese mes.
Conservar en nevera (entre 2 ° C y 8 ° C). No congelar. No use Aranesp si cree que se ha congelado.
Mantenga la jeringa precargada en el embalaje exterior para proteger el medicamento de la luz.
Una vez que la jeringa se ha sacado del refrigerador y se ha dejado a temperatura ambiente durante aproximadamente 30 minutos, antes de la inyección, debe usarse dentro de los 7 días o desecharse.
No utilice este medicamento si nota que el contenido de la jeringa precargada está turbio o tiene partículas visibles.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita, ya que esto ayudará a proteger el medio ambiente.
Composición y forma farmacéutica
Qué contiene Aranesp
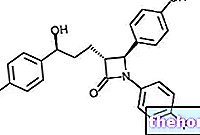
- El principio activo es darbepoetin alfa, r-HuEPO (eritropoyetina producida por ingeniería genética). La jeringa precargada contiene 10, 15, 20, 30, 40, 50, 60, 80, 100, 130, 150, 300 o 500 microgramos de darbepoetin alfa.
- Los demás componentes son fosfato de sodio monobásico, fosfato de sodio dibásico, cloruro de sodio, polisorbato 80 y agua para preparaciones inyectables.
Aspecto de Aranesp y contenido del envase
Aranesp es una solución inyectable transparente, incolora o ligeramente opalescente en una jeringa precargada.
Aranesp está disponible en envases de 1 o 4 jeringas precargadas. Las jeringas se envasan con blísteres (envases de 1 o 4 jeringas) o sin blísteres (envases de 1 jeringa). Es posible que no se comercialicen todos los tamaños de envases.
Prospecto fuente: AIFA (Agencia Italiana de Medicamentos). Contenido publicado en enero de 2016. Es posible que la información presente no esté actualizada.
Para tener acceso a la versión más actualizada, es recomendable acceder al sitio web de la AIFA (Agencia Italiana de Medicamentos). Descargo de responsabilidad e información útil.
01.0 NOMBRE DEL MEDICAMENTO
ARANESP
02.0 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Aranesp 10 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 10 microgramos de darbepoetin alfa en 0,4 ml (25 microgramos / ml).
Aranesp 15 microgramos solución inyectable en jeringa precargada.Cada jeringa precargada contiene 15 mcg de darbepoetin alfa en 0,375 ml (40 mcg / ml).
Aranesp 20 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 20 microgramos de darbepoetin alfa en 0,5 ml (40 microgramos / ml).
Aranesp 30 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 30 microgramos de darbepoetin alfa en 0,3 ml (100 microgramos / ml).
Aranesp 40 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 40 mcg de darbepoetin alfa en 0,4 ml (100 mcg / ml).
Aranesp 50 mcg solución inyectable en jeringa precargadaCada jeringa precargada contiene 50 mcg de darbepoetin alfa en 0,5 ml (100 mcg / ml).
Aranesp 60 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 60 mcg de darbepoetin alfa en 0,3 ml (200 mcg / ml).
Aranesp 80 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 80 microgramos de darbepoetin alfa en 0,4 ml (200 mcg / ml).
Aranesp 100 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 100 mcg de darbepoetin alfa en 0,5 ml (200 mcg / ml).
Aranesp 130 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 130 mcg de darbepoetin alfa en 0,65 ml (200 mcg / ml).
Aranesp 150 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 150 mcg de darbepoetin alfa en 0,3 ml (500 mcg / ml).
Aranesp 300 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 300 mcg de darbepoetin alfa en 0,6 ml (500 mcg / ml).
Aranesp 500 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 500 mcg de darbepoetin alfa en 1 ml (500 mcg / ml).
Aranesp 10 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 10 microgramos de darbepoetin alfa en 0,4 ml (25 microgramos / ml).
Aranesp 15 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 15 microgramos de darbepoetin alfa en 0,375 ml (40 mcg / ml).
Aranesp 20 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 20 microgramos de darbepoetin alfa en 0,5 ml (40 microgramos / ml).
Aranesp 30 microgramos solución inyectable en pluma precargada
Cada pluma precargada contiene 30 microgramos de darbepoetin alfa en 0,3 ml (100 microgramos / ml).
Aranesp 40 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 40 microgramos de darbepoetin alfa en 0,4 ml (100 microgramos / ml).
Aranesp 50 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 50 microgramos de darbepoetin alfa en 0,5 ml (100 microgramos / ml).
Aranesp 60 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 60 microgramos de darbepoetin alfa en 0,3 ml (200 microgramos / ml).
Aranesp 80 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 80 microgramos de darbepoetin alfa en 0,4 ml (200 microgramos / ml).
Aranesp 100 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 100 mcg de darbepoetin alfa en 0,5 ml (200 mcg / ml).
Aranesp 130 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 130 mcg de darbepoetin alfa en 0,65 ml (200 mcg / ml).
Aranesp 150 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 150 mcg de darbepoetin alfa en 0,3 ml (500 mcg / ml).
Aranesp 300 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 300 mcg de darbepoetin alfa en 0,6 ml (500 mcg / ml).
Aranesp 500 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 500 mcg de darbepoetin alfa en 1 ml (500 mcg / ml).
Aranesp 25 mcg solución inyectable en vial
Cada vial contiene 25 microgramos de darbepoetin alfa en 1 ml (25 microgramos / ml).
Aranesp 40 mcg solución inyectable en vial
Cada vial contiene 40 mcg de darbepoetin alfa en 1 ml (40 mcg / ml).
Aranesp 60 mcg solución inyectable en vial
Cada vial contiene 60 mcg de darbepoetin alfa en 1 ml (60 mcg / ml).
Aranesp 100 mcg solución inyectable en vial
Cada vial contiene 100 mcg de darbepoetin alfa en 1 ml (100 mcg / ml).
Aranesp 200 mcg solución inyectable en vial
Cada vial contiene 200 mcg de darbepoetin alfa en 1 ml (200 mcg / ml).
Aranesp 300 mcg solución inyectable en vial
Cada vial contiene 300 mcg de darbepoetin alfa en 1 ml (300 mcg / ml).
La darbepoetina alfa se produce mediante ingeniería genética en células de ovario de hámster chino (CHO-K1).
Excipiente (s) con efectos conocidos:
Aranesp 10 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,52 mg de sodio en 0,4 ml.
Aranesp 15 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,42 mg de sodio en 0,375 ml.
Aranesp 20 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,90 mg de sodio en 0,5 ml.
Aranesp 30 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,14 mg de sodio en 0,3 ml.
Aranesp 40 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,52 mg de sodio en 0,4 ml.
Aranesp 50 mcg solución inyectable en jeringa precargada
Cada jeringa precargada contiene 1,90 mg de sodio en 0,5 ml.
Aranesp 60 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,14 mg de sodio en 0,3 ml.
Aranesp 80 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,52 mg de sodio en 0,4 ml.
Aranesp 100 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,90 mg de sodio en 0,5 ml.
Aranesp 130 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 2,46 mg de sodio en 0,65 ml.
Aranesp 150 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 1,14 mg de sodio en 0,3 ml.
Aranesp 300 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 2,27 mg de sodio en 0,6 ml.
Aranesp 500 microgramos solución inyectable en jeringa precargada.
Cada jeringa precargada contiene 3,79 mg de sodio en 1 ml.
Aranesp 10 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 1,52 mg de sodio en 0,4 ml.
Aranesp 15 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 1,42 mg de sodio en 0,375 ml.
Aranesp 20 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 1,90 mg de sodio en 0,5 ml.
Aranesp 30 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 1,14 mg de sodio en 0,3 ml.
Aranesp 40 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 1,52 mg de sodio en 0,4 ml.
Aranesp 50 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 1,90 mg de sodio en 0,5 ml.
Aranesp 60 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 1,14 mg de sodio en 0,3 ml.
Aranesp 80 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 1,52 mg de sodio en 0,4 ml.
Aranesp 100 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 1,90 mg de sodio en 0,5 ml.
Aranesp 130 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 2,46 mg de sodio en 0,65 ml.
Aranesp 150 microgramos solución inyectable en pluma precargada.
Cada pluma precargada contiene 1,14 mg de sodio en 0,3 ml.
Aranesp 300 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 2,27 mg de sodio en 0,6 ml.
Aranesp 500 mcg solución inyectable en pluma precargada
Cada pluma precargada contiene 3,79 mg de sodio en 1 ml.
Aranesp 25 mcg solución inyectable en vial
Cada vial contiene 3,79 mg de sodio.
Aranesp 40 mcg solución inyectable en vial
Cada vial contiene 3,79 mg de sodio.
Aranesp 60 mcg solución inyectable en vial
Cada vial contiene 3,79 mg de sodio.
Aranesp 100 mcg solución inyectable en vial
Cada vial contiene 3,79 mg de sodio.
Aranesp 200 mcg solución inyectable en vial
Cada vial contiene 3,79 mg de sodio.
Aranesp 300 mcg solución inyectable en vial
Cada vial contiene 3,79 mg de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
03.0 FORMA FARMACÉUTICA
Solución inyectable (inyectable) en jeringa precargada.
Solución inyectable (inyección) en pluma precargada (SureClick).
Solución inyectable (inyectable) en vial.
Solución transparente e incolora.
04.0 INFORMACIÓN CLÍNICA
04.1 Indicaciones terapéuticas
Tratamiento de la anemia sintomática asociada con insuficiencia renal crónica (IRC) en pacientes adultos y pediátricos (ver sección 4.2).
Tratamiento de la anemia sintomática en pacientes adultos con neoplasias no mieloides que reciben quimioterapia.
04.2 Posología y forma de administración
El tratamiento con Aranesp debe iniciarlo un médico con experiencia en las indicaciones anteriores.
Dosis
Tratamiento de la anemia sintomática en pacientes adultos y pediátricos con insuficiencia renal crónica
Los síntomas y las secuelas de la anemia pueden variar según la edad, el sexo y la gravedad general de la enfermedad; por lo tanto, es necesario que el médico evalúe el curso clínico y las condiciones de cada paciente individual. Aranesp debe administrarse por vía subcutánea o intravenosa para aumentar la concentración de hemoglobina a no más de 12 g / dl (7,5 mmol / l). Es preferible el uso subcutáneo en pacientes que no se someten a hemodiálisis, para evitar la punción de las venas periféricas.
Los pacientes deben ser monitoreados de cerca para lograr un control adecuado de los síntomas de anemia usando la dosis más baja aprobada de Aranesp mientras se mantiene la concentración de hemoglobina por debajo o igual a 12 g / dl (7, 5 mmol / l). Se debe tener precaución al aumentar las dosis de Aranesp en pacientes con insuficiencia renal crónica.
En el caso de pacientes con mala respuesta de hemoglobina a Aranesp, se deben considerar causas alternativas de mala respuesta (ver secciones 4.4 y 5.1).
Debido a la variabilidad intrapaciente, ocasionalmente se pueden observar en el mismo sujeto valores únicos de hemoglobina por encima y por debajo del nivel de hemoglobina deseado. La variabilidad de la hemoglobina debe controlarse mediante el manejo de la dosis, teniendo en cuenta el rango de hemoglobina objetivo, que es de 10 g / dl (6,2 mmol / l) a 12 g / dl (7,5 mmol / l). Continuación de los valores de hemoglobina por encima de 12 g / dl (7,5 mmol / l); a continuación se proporcionan pautas para el ajuste apropiado de la dosis para valores de hemoglobina superiores a 12 g / dl (7,5 mmol / l) Un aumento de hemoglobina superior a 2 g / dl (1,25 mmol / l) durante un período de 4 semanas también debe evitarse. Si esto ocurriera, será necesario ajustar la dosis.
El tratamiento con Aranesp se divide en dos fases, una fase de corrección y una fase de mantenimiento. Las instrucciones se proporcionan por separado para pacientes adultos y pediátricos.
Pacientes adultos con insuficiencia renal crónica
Fase de corrección:
La dosis inicial para la administración subcutánea o intravenosa es de 0,45 mcg / kg de peso corporal, como inyección única una vez a la semana. Alternativamente, las siguientes dosis iniciales también se pueden administrar por vía subcutánea como una sola inyección a pacientes que no están en diálisis: 0,75 mcg / kg una vez cada dos semanas o 1,5 mcg / kg una vez al mes. Si el aumento de la hemoglobina es inadecuado (menos de 1 g / dl (0,6 mmol / l) durante cuatro semanas), la dosis debe aumentarse en aproximadamente un 25%. Los aumentos de dosis no deben realizarse más de una vez cada 4 semanas.
Si el aumento de hemoglobina es superior a 2 g / dl (1,25 mmol / l) en cuatro semanas, la dosis debe reducirse en aproximadamente un 25%.Si el valor de hemoglobina es superior a 12 g / dl (7,5 mmol / l), se debe considerar una reducción de la dosis. Si la hemoglobina continúa aumentando, la dosis debe reducirse en aproximadamente un 25%. Si el valor de hemoglobina continúa aumentando después de una reducción de la dosis, la administración debe suspenderse temporalmente hasta que se observe una disminución en la dosis. "Hemoglobina, luego reiniciar la terapia a una dosis aproximadamente un 25% menor que la dosis anterior.
La hemoglobina debe medirse cada una o dos semanas hasta que se haya estabilizado. Posteriormente, la hemoglobina puede medirse a intervalos más prolongados.
Fase de mantenimiento:
En pacientes en diálisis, Aranesp puede continuarse como una única inyección una vez a la semana o una vez cada dos semanas. Los pacientes en diálisis que cambien de Aranesp una vez a la semana a una vez cada dos semanas deben recibir inicialmente una dosis equivalente al doble de la dosis semanal anterior.
En pacientes que no están en diálisis, Aranesp puede seguir administrándose como una única inyección una vez a la semana o una vez cada dos semanas o una vez al mes. Para los pacientes tratados con Aranesp una vez cada dos semanas, después de alcanzar el objetivo de concentración de hemoglobina, Aranesp puede administrarse mediante inyección subcutánea una vez al mes comenzando con el doble de la dosis administrada previamente una vez cada dos semanas.
La dosis debe titularse según sea necesario para mantener la concentración de hemoglobina objetivo.
Si es necesario un ajuste de dosis para mantener la hemoglobina en el nivel deseado, se recomienda ajustar la dosis en aproximadamente un 25%.
Si el aumento de hemoglobina es superior a 2 g / dl (1,25 mmol / l) en cuatro semanas, la dosis debe reducirse en aproximadamente un 25%, dependiendo de la velocidad del aumento. Es superior a 12 g / dl (7,5 mmol / L), se debe considerar una reducción de la dosis Si la hemoglobina continúa aumentando, la dosis debe reducirse en aproximadamente un 25%. En el caso de que, tras una reducción de dosis, el valor de hemoglobina continúe aumentando, se debe suspender temporalmente la administración hasta que se observe una disminución de la hemoglobina, reiniciando así la terapia a una dosis aproximadamente un 25% inferior a la dosis anterior.
Después de cualquier ajuste de la dosis o el horario de dosificación, se debe controlar la hemoglobina cada una o dos semanas. Los cambios de dosis en la fase de mantenimiento no deben realizarse con más frecuencia que una vez cada dos semanas.
Cuando se cambia la vía de administración, se debe usar la misma dosis y se debe controlar la hemoglobina cada una o dos semanas para ajustar la dosis y mantener la hemoglobina en el nivel deseado.
Los estudios clínicos han demostrado que los pacientes adultos que reciben r-HuEPO una, dos o tres veces por semana pueden cambiar a Aranesp una vez a la semana o cada dos semanas. La dosis semanal inicial de Aranesp (mcg / semana) se puede calcular dividiendo la dosis semanal total de r-HuEPO (UI / semana) por 200. La dosis inicial de Aranesp que se administrará cada dos semanas (mcg durante dos semanas) se puede calcular dividiendo la dosis total de r-HuEPO administrada durante un período de dos semanas por 200. Dada la variabilidad individual, se espera que la dosis tenga que ser modulada para definir la dosis terapéutica óptima para el paciente individual. Al reemplazar r-HuEPO con Aranesp, se debe controlar la hemoglobina cada una o dos semanas y se debe utilizar la misma vía de administración.
Población pediátrica con insuficiencia renal crónica
No hay datos sobre el tratamiento de pacientes pediátricos menores de 1 año en ensayos clínicos aleatorizados (ver sección 5.1).
Fase de corrección:
Para pacientes ≥ 1 año de edad, la dosis inicial para la administración subcutánea o intravenosa es de 0,45 mcg / kg de peso corporal, en una sola inyección una vez a la semana. Alternativamente, los pacientes que no están en diálisis pueden recibir una dosis inicial de 0,75 mcg / kg en una única inyección subcutánea una vez cada dos semanas. Si el aumento de la hemoglobina es inadecuado (menos de 1 g / dl (0,6 mmol / l) durante cuatro semanas), la dosis debe aumentarse en aproximadamente un 25%. Los aumentos de dosis no deben realizarse más de una vez cada cuatro semanas.
Si el aumento de hemoglobina es superior a 2 g / dl (1,25 mmol / l) en cuatro semanas, la dosis debe reducirse en aproximadamente un 25%, dependiendo de la velocidad del aumento. Es superior a 12 g / dl (7,5 mmol / L), se debe considerar una reducción de la dosis Si la hemoglobina continúa aumentando, la dosis debe reducirse en aproximadamente un 25%. En el caso de que, tras una reducción de dosis, el valor de hemoglobina continúe aumentando, se debe suspender temporalmente la administración hasta que se observe una disminución de la hemoglobina, reiniciando así la terapia a una dosis aproximadamente un 25% inferior a la dosis anterior.
La hemoglobina debe medirse cada una o dos semanas hasta que se haya estabilizado. Posteriormente, la hemoglobina puede medirse a intervalos más prolongados.
No se ha estudiado la corrección de la anemia con Aranesp con una frecuencia de una vez al mes en pacientes pediátricos.
Fase de mantenimiento:
Para pacientes pediátricos ≥ 1 año de edad, durante la fase de mantenimiento, Aranesp puede continuarse como una inyección única una vez a la semana o una vez cada dos semanas. Los pacientes envejecieron los niveles de hemoglobina en comparación con los pacientes mayores. Los pacientes en diálisis que cambian de Aranesp una vez a la semana a una vez cada dos semanas deben recibir inicialmente una dosis equivalente al doble de la dosis semanal anterior.
En pacientes no sometidos a diálisis de 3 a 11 años, una vez que se alcanza la concentración de hemoglobina objetivo una vez cada dos semanas, Aranesp puede administrarse mediante inyección subcutánea una vez al mes comenzando con el doble de la dosis administrada previamente, una vez cada dos semanas.
Los datos clínicos en pacientes pediátricos han demostrado que los pacientes que reciben r-HuEPO, dos o tres veces por semana pueden cambiarse a Aranesp una vez a la semana, y los pacientes que reciben r-HuEPO una vez a la semana pueden cambiar a la administración de r-HuEPO una vez a la semana. Aranesp cada dos semanas. La dosis pediátrica semanal inicial de Aranesp (mcg / semana) se puede calcular dividiendo la dosis semanal total de r-HuEPO (UI / semana) por 240. La dosis inicial cada dos semanas de Aranesp (mcg / cada dos semanas) se puede calcular dividiendo la dosis acumulada total de r-HuEPO administrada durante dos semanas por 240. Dada la variabilidad individual, se espera que cada dosis individual deba ser paciente la dosis terapéutica óptima Cuando se reemplace r-HuEPO con Aranesp, se debe controlar la hemoglobina cada una o dos semanas, y se debe usar la misma vía de administración.
La dosis debe titularse según sea necesario para mantener la concentración de hemoglobina objetivo.
Si es necesario un ajuste de dosis para mantener la hemoglobina en el nivel deseado, se recomienda ajustar la dosis en aproximadamente un 25%.
Si el aumento de hemoglobina es superior a 2 g / dl (1,25 mmol / l) en cuatro semanas, la dosis debe reducirse en aproximadamente un 25%, dependiendo de la velocidad del aumento. Es superior a 12 g / dl (7,5 mmol / l), se debe considerar una reducción de la dosis.Si el valor de hemoglobina continúa aumentando, la dosis debe reducirse en aproximadamente un 25% .Una reducción de la dosis, el valor de hemoglobina continúa aumentando, la administración deberá suspenderse temporalmente. hasta que se observe una disminución de la hemoglobina, luego reiniciar la terapia a una dosis aproximadamente un 25% menor que la dosis anterior.
Los pacientes que inicien diálisis durante el tratamiento con Aranesp deben ser monitoreados de cerca para un control adecuado de sus niveles de hemoglobina.
Después de cualquier ajuste de la dosis o el horario de dosificación, se debe controlar la hemoglobina cada una o dos semanas. Los cambios de dosis en la fase de mantenimiento no deben realizarse con más frecuencia que una vez cada dos semanas.
Cuando se cambia la vía de administración, se debe usar la misma dosis y se debe controlar la hemoglobina cada una o dos semanas para ajustar la dosis y mantener la hemoglobina en el nivel deseado.
Tratamiento de la anemia sintomática inducida por quimioterapia en pacientes con cáncer
Aranesp debe administrarse por vía subcutánea a pacientes anémicos (p. Ej., Concentración de hemoglobina ≤ 10 g / dl (6,2 mmol / l) para aumentar el valor de hemoglobina a no más de 12 g / dl (7,5 mmol / l). Síntomas y secuelas de la anemia puede variar según la edad, el sexo y la gravedad general de la enfermedad, por lo que es necesario que el médico evalúe el curso clínico y el estado de cada paciente individual.
Debido a la variabilidad intrapaciente, ocasionalmente se pueden observar en el mismo sujeto valores únicos de hemoglobina por encima y por debajo del nivel de hemoglobina deseado. La variabilidad de la hemoglobina debe controlarse mediante el manejo de la dosis, teniendo en cuenta el rango de hemoglobina objetivo, que es de 10 g / dl (6,2 mmol / l) a 12 g / dl (7,5 mmol / l). Es necesario evitar valores persistentes de hemoglobina. Por encima de 12 g / dl (7,5 mmol / l); a continuación se muestran las indicaciones para un ajuste de dosis adecuado en caso de valores de hemoglobina superiores a 12 g / dl (7, 5 mmol / l).
La dosis inicial recomendada es de 500 microgramos (6,75 microgramos / kg) administrados una vez cada tres semanas o 2,25 microgramos / kg de peso corporal una vez a la semana. Si la respuesta clínica del paciente (fatiga, respuesta de la hemoglobina) es inadecuada después de nueve semanas, es posible que la continuación del tratamiento no sea eficaz.
La terapia con Aranesp debe suspenderse aproximadamente 4 semanas después del final del ciclo de quimioterapia.
Una vez que se alcanza el objetivo de tratamiento para el paciente individual, la dosis debe reducirse en un 25-50% para asegurar que se use la dosis más baja aprobada de Aranesp para mantener la hemoglobina a un nivel que controle los síntomas de la anemia. Titulación de la dosis adecuada entre 500 Se deben considerar mcg, 300 mcg y 150 mcg.
Se debe vigilar estrechamente a los pacientes, reduciendo la dosis en aproximadamente un 25-50% si la hemoglobina supera los 12 g / dl (7,5 mmol / l). Si los niveles de hemoglobina superan los 13 g / dl (8,1 mmol / l), se debe administrar el tratamiento con Aranesp. Debe interrumpirse temporalmente el tratamiento con una dosis aproximadamente un 25% inferior a la dosis anterior, después de que el nivel de hemoglobina haya descendido a 12 g / dl o menos (7,5 mmol / l).
Si el aumento de hemoglobina es superior a 2 g / dl (1,25 mmol / l) durante un período de 4 semanas, la dosis debe reducirse en un 25-50%.
Método de administración
Aranesp 10, 15, 20, 30, 40, 50, 60, 80, 100, 130, 150, 300, 500 mcg solución inyectable en jeringa precargada
Aranesp se administra por vía subcutánea o intravenosa como se describe en la posología.
Alterne los lugares de inyección e inyecte lentamente para minimizar las molestias en el lugar de la inyección. Aranesp se suministra listo para usar en jeringas precargadas.
Aranesp 10, 15, 20, 30, 40, 50, 60, 80, 100, 130, 150, 300, 500 mcg solución inyectable en pluma precargada
Aranesp en pluma precargada es solo para administración subcutánea.
Lugares de inyección alternativos para minimizar las molestias en el lugar de la inyección.
Aranesp se suministra listo para usar en una pluma precargada.
Aranesp 25, 40, 60, 100, 200, 300 mcg solución inyectable en vial
Aranesp se administra por vía subcutánea o intravenosa como se describe en la posología.
Alterne los lugares de inyección e inyecte lentamente para minimizar las molestias en el lugar de la inyección.
Aranesp se suministra listo para usar en un vial.
Las instrucciones de uso, manipulación y eliminación se dan en la sección 6.6.
04.3 Contraindicaciones
Hipersensibilidad al principio activo oa alguno de los excipientes incluidos en la sección 6.1.
Hipertensión incontrolada.
04.4 Advertencias especiales y precauciones de uso apropiadas
General
Para mejorar la trazabilidad de los agentes estimulantes de la eritropoyesis (AEE), el nombre comercial del AEE administrado debe registrarse (o informarse) claramente en la historia clínica del paciente.
Se debe controlar la presión arterial en todos los pacientes, especialmente durante el inicio del tratamiento con Aranesp. Si la presión arterial es difícil de controlar tomando las medidas adecuadas, se puede reducir la hemoglobina disminuyendo o interrumpiendo la administración de Aranesp (ver párrafo 4.2). Se han observado casos de hipertensión grave, que incluyen crisis hipertensiva, encefalopatía hipertensiva y convulsiones, en pacientes con IRC tratados con Aranesp.
Para garantizar una eritropoyesis eficaz, se deben controlar las reservas de hierro en todos los pacientes antes y durante la terapia y es posible que se requiera una terapia de hierro suplementaria.
La falta de respuesta a la terapia con Aranesp debe llevar a investigar los factores causales Las deficiencias de hierro, ácido fólico o vitamina B12 reducen la eficacia de los AEE y por lo tanto deben corregirse. Las infecciones intercurrentes, los episodios inflamatorios o traumáticos, la pérdida de sangre oculta, la hemólisis, la intoxicación grave por aluminio, las enfermedades hematológicas subyacentes o la fibrosis de la médula ósea pueden comprometer la respuesta eritropoyética. Se debe considerar un recuento de reticulocitos como parte de la evaluación. Si se han excluido las causas típicas de falta de respuesta y el paciente presenta reticulocitopenia, se debe considerar un examen de médula ósea Si la médula ósea es compatible con un diagnóstico de PRCA, se debe realizar una prueba de anticuerpos -eritropoyetina.
Se ha informado de aplasia pura de glóbulos rojos causada por anticuerpos neutralizantes de la eritropoyetina en asociación con el tratamiento con ESA, incluido Aranesp. Este hallazgo se ha notificado predominantemente en pacientes con insuficiencia renal crónica (IRC) tratados por vía subcutánea. Se ha demostrado que estos anticuerpos reaccionan de forma cruzada con todas las proteínas eritropoyéticas, y los pacientes con sospecha o presencia confirmada de anticuerpos neutralizantes de eritropoyetina no deben iniciar el tratamiento con Aranesp (ver sección 4.8).
Una disminución paradójica de la hemoglobina y la aparición de una anemia grave asociada a un recuento bajo de reticulocitos debe llevar a la interrupción inmediata del tratamiento con epoetina y a la ejecución de la prueba de anticuerpos anti-eritropoyetina. Se han notificado casos en pacientes con hepatitis C tratados con interferón y ribavirina cuando se utilizaron epoetinas de forma concomitante. Las epoetinas no están aprobadas para el tratamiento de la anemia asociada con la hepatitis C.
La enfermedad hepática activa fue un criterio de exclusión en todos los estudios con Aranesp, por lo que no hay datos disponibles en pacientes con insuficiencia hepática. Dado que se cree que el hígado es la principal vía de eliminación de darbepoetin alfa y r-HuEPO, Aranesp debe utilizarse con precaución en pacientes con enfermedad hepática.
Aranesp debe utilizarse con precaución en pacientes con anemia de células falciformes.
El uso indebido de Aranesp por parte de personas sanas puede provocar un aumento excesivo del hematocrito. Esto puede estar asociado con complicaciones cardiovasculares que ponen al sujeto en peligro inmediato de vida.
El capuchón de la aguja de la jeringa precargada o de la pluma precargada contiene caucho natural seco (un derivado del látex) que puede provocar reacciones alérgicas.
Aranesp debe utilizarse con precaución en pacientes con epilepsia. Se han notificado convulsiones en pacientes que reciben Aranesp.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, esencialmente exento de sodio.
Pacientes con insuficiencia renal crónica
En pacientes con insuficiencia renal crónica, la hemoglobina debe mantenerse a un nivel que no supere el límite superior de la concentración de hemoglobina objetivo recomendada en la sección 4.2. En los ensayos clínicos se ha observado un aumento del riesgo de muerte, eventos cardiovasculares o cardiovasculares graves. incluyendo ictus y trombosis de accesos vasculares en caso de administración de AEE con el objetivo de alcanzar un valor de hemoglobina superior a 12 g / dl (7,5 mmol / l).
Se debe tener precaución al aumentar las dosis de Aranesp en pacientes con insuficiencia renal crónica, ya que las dosis altas acumuladas de epoetina pueden estar asociadas con un mayor riesgo de mortalidad, eventos cardiovasculares y cerebrovasculares graves. En el caso de pacientes con mala respuesta de la hemoglobina a las epoetinas. Se deben considerar causas alternativas para la mala respuesta (ver secciones 4.2 y 5.1).
Los ensayos clínicos controlados no han demostrado un beneficio significativo atribuible a la administración de epoetinas cuando la concentración de hemoglobina se ha incrementado más allá del nivel necesario para controlar los síntomas de la anemia y evitar las transfusiones de sangre.
Se recomienda la terapia con hierro suplementario en todos los pacientes con valores de ferritina sérica por debajo de 100 mcg / L o saturación de transferrina por debajo del 20%.
Los niveles séricos de potasio deben controlarse periódicamente durante el tratamiento con Aranesp. Se han notificado elevaciones del potasio en algunos pacientes que reciben Aranesp, aunque no se ha establecido una correlación con el tratamiento. Si se observan niveles de potasio elevados o en aumento, se debe considerar interrumpir la administración de Aranesp hasta que se corrija este nivel.
Pacientes con cáncer
Efecto sobre la progresión tumoral
Las epoetinas son factores de crecimiento que estimulan principalmente la producción de glóbulos rojos. Los receptores de eritropoyetina se pueden expresar en la superficie de varias células cancerosas. Como ocurre con todos los factores de crecimiento, existe la preocupación de que las epoetinas puedan estimular el crecimiento de tumores. En varios ensayos clínicos controlados, no se ha demostrado que las epoetinas mejoren la supervivencia general o reduzcan el riesgo de progresión del tumor en pacientes con anemia asociada con neoplasias malignas.
En ensayos clínicos controlados con administración de Aranesp y otros AEE, se ha demostrado lo siguiente:
• Reducción del tiempo hasta la progresión del tumor en pacientes con cáncer de cabeza y cuello avanzado tratados con radioterapia, cuando se han administrado AEE para alcanzar un valor de hemoglobina objetivo superior a 14 g / dl (8, 7 mmol / l); el uso de AEE no está indicado en esta población de pacientes.
• Reducción de la supervivencia global y aumento de muertes atribuidas a la progresión de la enfermedad a los 4 meses en pacientes con cáncer de mama metastásico tratadas con quimioterapia, cuando se administra para alcanzar un valor de hemoglobina objetivo de 12-14 g / dl (7,5-8,7 mmol / l).
• Mayor riesgo de muerte en caso de posología destinada a alcanzar un valor de hemoglobina de 12 g / dl (7,5 mmol / l) en pacientes con neoplasias malignas activas no tratadas con quimioterapia o radioterapia. El uso de AEE no está indicado en esta población de pacientes.
Con base en lo anterior, en algunas condiciones clínicas, la transfusión de sangre debe ser el tratamiento preferido para el manejo de la anemia en pacientes con cáncer. La decisión de administrar eritropoyetinas recombinantes debe basarse en una evaluación de la relación beneficio-riesgo con la participación de cada paciente. y deben tener en cuenta el contexto clínico específico. Los factores a considerar en esta evaluación deben incluir el tipo de cáncer y su estadio, el grado de anemia, la esperanza de vida, el entorno en el que se trata al paciente y las preferencias del paciente (ver sección 5.1).
En pacientes con tumores sólidos o neoplasias linfoproliferativas, si el valor de hemoglobina supera los 12 g / dl (7,5 mmol / l), se debe observar estrictamente el ajuste de dosis descrito en la sección 4.2 para minimizar el riesgo de eventos tromboembólicos. El recuento de plaquetas y el nivel de hemoglobina deben controlarse a intervalos regulares.
04.5 Interacciones con otros medicamentos y otras formas de interacción
Los resultados clínicos obtenidos hasta la fecha no indican ninguna interacción de darbepoetin alfa con otras sustancias. Sin embargo, existe la posibilidad de una "interacción con sustancias que se unen significativamente a los glóbulos rojos, como ciclosporina y tacrolimus. Si Aranesp se administra concomitantemente con uno de estos tratamientos, se deben controlar los niveles en sangre de este último y ajustar su dosis". según el aumento de hemoglobina.
04.6 Embarazo y lactancia
El embarazo
No existen estudios adecuados y bien controlados sobre el uso de Aranesp en mujeres embarazadas.
Los estudios en animales no indicaron efectos nocivos directos sobre el embarazo, el desarrollo embrionario / fetal, el parto o el desarrollo posnatal. No se observó deterioro de la fertilidad.
Se debe tener precaución al prescribir Aranesp a mujeres embarazadas.
Se anima a las mujeres que quedan embarazadas mientras reciben tratamiento con Aranesp a que se inscriban en el Programa de Vigilancia del Embarazo de Amgen. Los datos de contacto se proporcionan en la sección 6 del prospecto.
Hora de la comida
Se desconoce si Aranesp se excreta en la leche materna. No se puede excluir un riesgo para los bebés. Se debe decidir si interrumpir la lactancia o interrumpir / abstenerse del tratamiento con Aranesp teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio del tratamiento para la mujer.
04.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Aranesp tiene una influencia nula o insignificante sobre la capacidad para conducir o utilizar máquinas.
04.8 Efectos indeseables
Resumen del perfil de seguridad
Las reacciones adversas identificadas asociadas con el uso de Aranesp son hipertensión, accidente cerebrovascular, eventos tromboembólicos, convulsiones, reacciones alérgicas, erupción / eritema y aplasia pura de glóbulos rojos (PRCA); ver sección 4.4.
El dolor en el lugar de la inyección se consideró atribuible al tratamiento en estudios en los que Aranesp se administró como inyección subcutánea. Las molestias en el lugar de la inyección fueron generalmente leves y transitorias y se produjeron predominantemente después de la primera inyección.
Tabla de reacciones adversas
La incidencia de reacciones adversas se presenta a continuación por sistema de clasificación de órganos y por clasificación de frecuencia. Las frecuencias se definen como: Muy frecuentes (≥ 1/10); frecuentes (≥ 1/100,
Los datos se presentan por separado para pacientes con insuficiencia renal crónica y pacientes con cáncer para reflejar los diferentes perfiles de reacciones adversas en estas poblaciones.
Pacientes con insuficiencia renal crónica
Los datos presentados de los ensayos clínicos controlados incluyeron 1357 pacientes, 766 tratados con Aranesp y 591 pacientes tratados con r-HuEPO. En el grupo de Aranesp, el 83% de los pacientes recibieron tratamiento de diálisis y el 17% no estaban en diálisis. El accidente cerebrovascular se identificó como una reacción adversa en un estudio clínico adicional (TRATAR, ver sección 5.1).
La incidencia de reacciones adversas en los ensayos clínicos controlados y el uso poscomercialización es la siguiente:
* ver sección "Descripción de reacciones adversas seleccionadas"
Pacientes con cáncer
Las reacciones adversas se determinaron en base a los datos recopilados de siete estudios aleatorizados, doble ciego y controlados con placebo en los que participaron un total de 2112 pacientes (1200 Aranesp, 912 placebo). Los ensayos clínicos incluyeron pacientes con tumores sólidos (por ejemplo, cánceres de pulmón, mama, colon y ovario) y neoplasias linfoides (por ejemplo, linfoma, mieloma múltiple).
La incidencia de reacciones adversas en los ensayos clínicos controlados y el uso poscomercialización es la siguiente:
* ver sección "Descripción de reacciones adversas seleccionadas"
Descripción de reacciones adversas seleccionadas
Pacientes con insuficiencia renal crónica
En TREAT, los accidentes cerebrovasculares se notificaron como frecuentes en pacientes con IRC (ver sección 5.1).
En casos aislados, aplasia pura de glóbulos rojos (PRCA) con anticuerpos neutralizantes de eritropoyetina asociada con la terapia con Aranesp, predominantemente en pacientes con IRC tratados por vía subcutánea. Si se diagnostica PRCA, se debe interrumpir el tratamiento con Aranesp y no se debe tratar a los pacientes con otra proteína eritropoyética recombinante (ver sección 4.4).
Según los datos de los ensayos clínicos, la frecuencia de todas las reacciones de hipersensibilidad se definió como muy común en los pacientes con IRC. Se han notificado reacciones de hipersensibilidad graves asociadas con el uso de darbepoetin alfa, que incluyen reacción anafiláctica, angioedema, broncoespasmo alérgico, erupción cutánea y urticaria.
Se han notificado convulsiones en pacientes que reciben darbepoetin alfa (ver sección 4.4).
Según los datos de los ensayos clínicos, la frecuencia se define como poco común en pacientes con IRC.
Pacientes con cáncer
Durante el uso poscomercialización, se ha observado hipertensión en pacientes con cáncer (ver sección 4.4) Según los datos de los ensayos clínicos, la frecuencia se define como común en pacientes con cáncer y también común en los grupos tratados con placebo.
Durante el uso poscomercialización, se han observado reacciones de hipersensibilidad en pacientes con cáncer. Según los datos de los ensayos clínicos, la frecuencia se define como muy común en pacientes con cáncer. Las reacciones de hipersensibilidad fueron muy comunes. reacciones de hipersensibilidad asociadas con el uso de darbepoetin alfa que incluyen reacción anafiláctica, angioedema, broncoespasmo alérgico, erupción cutánea y urticaria.
Durante el uso poscomercialización, se han notificado convulsiones en pacientes que recibieron darbepoetin alfa (ver sección 4.4). Según los datos de los ensayos clínicos, la frecuencia se define como poco común en pacientes con cáncer. Las convulsiones fueron frecuentes en los grupos de placebo.
Población pediátrica con insuficiencia renal crónica
En todos los ensayos clínicos pediátricos en el IRC, no se identificaron reacciones adversas adicionales en pacientes pediátricos que las notificadas previamente en pacientes adultos (ver sección 5.1).
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas que se produzcan después de la autorización del medicamento, ya que permite un seguimiento continuo de la relación beneficio / riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas al sistema nacional de notificación. Italiana del Farmaco - Sitio web: http // www.agenziafarmaco.gov.it / it / managers).
04.9 Sobredosis
No se ha determinado la cantidad máxima de Aranesp que se puede administrar de forma segura en dosis únicas o múltiples. El tratamiento con Aranesp puede producir policitemia si la hemoglobina no se controla cuidadosamente y la dosis no se ajusta adecuadamente Se han observado casos de hipertensión grave tras una sobredosis de Aranesp (ver sección 4.4).
En caso de policitemia, Aranesp debe suspenderse temporalmente (ver sección 4.2). Si está clínicamente indicado, se puede realizar una flebotomía.
05.0 PROPIEDADES FARMACOLÓGICAS
05.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: preparaciones antianémicas, otras preparaciones antianémicas. Código ATC: B03XA02.
Mecanismo de acción
La eritropoyetina humana, una hormona glicoproteica endógena, es el principal regulador de la eritropoyesis a través de la interacción específica con el receptor de eritropoyetina en las células progenitoras eritroides en la médula ósea. La producción de eritropoyetina ocurre principalmente y se regula en el riñón en respuesta a cambios en la oxigenación tisular. La producción de eritropoyetina endógena se reduce en pacientes con insuficiencia renal crónica y la deficiencia de eritropoyetina es la causa principal de anemia en estos pacientes. En los pacientes con cáncer que reciben quimioterapia, la etiología de la anemia es multifactorial. En estos pacientes, la deficiencia de eritropoyetina y una respuesta reducida de las células progenitoras eritroides a la eritropoyetina endógena son factores que contribuyen significativamente a la anemia.
Efectos farmacodinámicos
Darbepoetin alfa estimula la eritropoyesis con el mismo mecanismo que la hormona endógena. La darbepoetina alfa tiene cinco cadenas de carbohidratos unidas al extremo N, mientras que la hormona endógena y las eritropoyetinas humanas recombinantes (r-HuEPO) tienen tres. Los residuos de carbohidratos adicionales no se distinguen a nivel molecular de los presentes en la hormona endógena. Debido al mayor contenido de carbohidratos, la darbepoetina alfa tiene una vida media terminal más prolongada que la r-HuEPO y, por lo tanto, una mayor actividad. en vivo. A pesar de estas modificaciones moleculares, darbepoetin alfa mantiene una especificidad muy alta por el receptor de eritropoyetina.
Eficacia clínica y seguridad
Pacientes con insuficiencia renal crónica
En dos estudios clínicos, los pacientes con IRC tuvieron un mayor riesgo de muerte y eventos cardiovasculares graves cuando se administraron AEE para alcanzar niveles de hemoglobina más altos que niveles de hemoglobina más bajos (13,5 g / dl (8,4 mmol / l) frente a 11,3 g / dl (7,1 mmol / l); 14 g / dl (8,7 mmol / l) versus 10 g / dl (6,2 mmol / l)).
En un estudio de corrección aleatorizado, doble ciego (n = 358) que comparó los esquemas de dosificación una vez cada dos semanas y una vez al mes en pacientes con IRC que no estaban en diálisis, la dosificación de darbepoetina alfa una vez al día al mes resultó en la corrección de la anemia como mínimo de una vez cada dos semanas. El tiempo medio (cuartil 1, cuartil 3) para lograr la corrección de la hemoglobina (≥ 10,0 g / dl y aumento de ≥ 1,0 g / dl desde el inicio) fue de 5 semanas para ambos una vez cada dos semanas ( 3,7 semanas) y una vez al mes (3,9 semanas). Durante el período de evaluación (semanas 29 - 33), la dosis equivalente semanal media (IC del 95%) fue de 0,20 (0,17 - 0,24) mcg / kg en el brazo de una vez cada dos semanas y de 0,27 (0,23 - 0,32) mcg / kg en el brazo una vez al mes.
En un estudio aleatorizado, doble ciego, controlado con placebo (TREAT) de 4.038 pacientes con IRC sin diálisis con diabetes tipo 2 y niveles de hemoglobina ≤ 11 g / dl, los pacientes recibieron tratamiento con darbepoetina alfa para alcanzar los niveles de hemoglobina objetivo de 13 g / dl. dl o placebo (con tratamiento de recuperación con darbepoetin alfa a niveles de hemoglobina inferiores a 9 g / dl). El estudio no cumplió con el objetivo principal de demostrar una reducción en el riesgo de mortalidad por todas las causas o morbilidad cardiovascular (darbepoetina alfa versus placebo; HR 1,05, IC del 95% (0,94 a 1,17)), o Mortalidad por todas las causas o Etapa terminal enfermedad renal (ESRD) (darbepoetin alfa versus placebo; HR 1.06, 95% CI (0.95-1.19)). Un "análisis de componentes individuales del punto final compuesto mostró el siguiente HR (95% CI): muerte 1.05 (0.92-1.21 ), insuficiencia cardíaca congestiva (ICC) 0,89 (0,74-1,08), infarto de miocardio (IM) 0,96 (0,75-1,23), ictus 1,92 (1,38-2,68), hospitalización por isquemia miocárdica 0,84 (0,55-1,27), ERT 1,02 (0,87) -1,18).
Se realizaron análisis combinados post-hoc de ensayos clínicos con AEE en pacientes con insuficiencia renal crónica (en diálisis, no en diálisis, diabéticos, no diabéticos). Hubo una tendencia hacia un mayor riesgo estimado de mortalidad por todas las causas, eventos cardiovasculares y cerebrovasculares asociados con dosis acumuladas más altas de AEE, independientemente del estado de diabetes o diálisis (ver secciones 4.2 y 4.4).
Población pediátrica
En un ensayo clínico aleatorizado, 114 pacientes pediátricos de 2 a 18 años con enfermedad renal crónica, en diálisis o no diálisis, que estaban anémicos (hemoglobina
En un ensayo clínico de 124 pacientes pediátricos con enfermedad renal crónica en diálisis o no diálisis de 1 a 18 años, los pacientes que estaban estables con epoetina alfa fueron aleatorizados para recibir darbepoetina alfa administrada una vez a la semana (por vía subcutánea o intravenosa) utilizando una tasa de conversión de dosis de 238: 1, o continuar con la terapia con epoetina alfa a la misma dosis, horario y vía de administración. El criterio principal de valoración de la eficacia [cambio en los niveles de hemoglobina entre el valor inicial y el período de evaluación (semana 21-28)] fue similar entre los dos grupos. Los niveles medios de hemoglobina para rHuEPO y darbepoetin alfa al inicio fueron 11, 1 (DE 0,7) g / dL y 11,3 (DE 0,6) g / dL, respectivamente. Los niveles medios de hemoglobina en la semana 28 para rHuEPO y darbepoetin alfa fueron 11,1 (DE 1,4) g / dl y 11,1 (DE 1,1) g / dl, respectivamente.
En un estudio de registro observacional europeo que incluyó a 319 pacientes pediátricos con enfermedad renal crónica (13 (4,1%) pacientes de edad
En estos estudios, no se identificaron diferencias significativas entre el perfil de seguridad para pacientes pediátricos y el informado previamente para pacientes adultos (ver sección 4.8).
Pacientes con cáncer y sometidos a quimioterapia
En un estudio prospectivo, aleatorizado, doble ciego y controlado con placebo de 314 pacientes con cáncer de pulmón que recibieron quimioterapia a base de platino, se encontró una reducción significativa en la necesidad de transfusiones (p
Los estudios clínicos han demostrado que darbepoetin alfa tiene una eficacia similar cuando se administra en una sola inyección una vez cada 3 semanas, una vez cada dos semanas o semanalmente sin necesidad de aumentar la dosis total.
La tolerabilidad y eficacia de administrar Aranesp una vez cada 3 semanas para reducir la necesidad de transfusiones en pacientes sometidos a quimioterapia se evaluó en un estudio internacional, aleatorizado, doble ciego, que se llevó a cabo en 705 pacientes. Anemia con neoplasias no mieloides y sometidos a varios ciclos de quimioterapia. Los pacientes fueron aleatorizados para recibir Aranesp en dosis de 500 mcg una vez cada 3 semanas o en dosis de 2,25 mcg / kg una vez a la semana. En ambos grupos, la dosis se redujo en un 40% con respecto a la dosis anterior (p. ej. la primera reducción de dosis, se redujo a 300 mcg en el grupo de una vez cada 3 semanas y a 1,35 mcg / kg en el grupo de una vez a la semana), en el caso de un aumento de la hemoglobina de más de 1 g / dl en 14 días . En el grupo de una vez cada 3 semanas, el 72% de los pacientes requirió una reducción de la dosis. En el grupo de una vez a la semana, el 75% de los pacientes requirió una reducción de la dosis. Este estudio demuestra que la dosis de 500 mcg cada 3 semanas es comparable a la dosis una vez a la semana en términos de la incidencia de pacientes que requieren al menos una transfusión entre la semana 5 y el final del tratamiento.
En un estudio prospectivo, aleatorizado, doble ciego y controlado con placebo de 344 pacientes anémicos con neoplasias linfoproliferativas y sometidos a quimioterapia, se encontró una reducción significativa en la necesidad de transfusiones y una mejora en la respuesta de la hemoglobina (p
La eritropoyetina es un factor de crecimiento que estimula principalmente la producción de glóbulos rojos. Los receptores de eritropoyetina se pueden expresar en la superficie de varias células cancerosas.
La supervivencia y la progresión del tumor se evaluaron en cinco grandes ensayos clínicos controlados que incluyeron un total de 2.833 pacientes; cuatro de los cuales fueron estudios doble ciego y controlados con placebo y uno fue de etiqueta abierta. Dos de estos estudios incluyeron pacientes que estaban siendo tratados con quimioterapia. La concentración de hemoglobina objetivo fue superior a 13 g / dl en dos estudios; en los tres estudios restantes fue de 12-14 g / dl. En el estudio de etiqueta abierta, no se observaron diferencias en la supervivencia global entre los pacientes tratados con eritropoyetinas humanas recombinantes y los pacientes de control. En los cuatro estudios controlados con placebo, las razones de riesgo para la supervivencia general variaron de 1,25 a 2,47 a favor del grupo de control. Estos estudios mostraron, en comparación con los controles, un aumento constante e inexplicable estadísticamente significativo en la mortalidad en pacientes con anemia asociada con varios tipos de tumores comunes y que recibieron eritropoyetina humana recombinante. El resultado de supervivencia general en estos estudios no pudo explicarse satisfactoriamente en función de la diferencia en la incidencia de trombosis y las complicaciones asociadas entre los pacientes tratados con eritropoyetina humana recombinante y los del grupo de control.
También se realizó un análisis sistemático de 57 estudios clínicos que incluyeron a más de 9.000 pacientes con cáncer. El metanálisis de los datos de supervivencia general mostró una estimación puntual del Hazard Ratio de 1,08 a favor de los controles (IC del 95%: 0,99-1,18; 42 estudios y 8.167 pacientes).
Se observó un aumento del riesgo relativo de eventos tromboembólicos (RR 1,67, IC del 95%: 1,35-2,06, 35 estudios y 6.769 pacientes) en pacientes tratados con eritropoyetina humana recombinante. Por lo tanto, existe evidencia consistente que sugiere que puede haber un daño significativo en pacientes con cáncer tratados con eritropoyetina humana recombinante. No está claro en qué medida estos resultados son aplicables a la administración de eritropoyetina humana recombinante a pacientes con cáncer sometidos a quimioterapia para lograr concentraciones de hemoglobina por debajo de 13 g / dl, ya que se incluyeron pocos pacientes con estas características en los datos analizados.
También se realizó un análisis de datos de pacientes individuales en más de 13,900 pacientes con cáncer (quimio, radio, quimiorradio o sin terapia) que participaron en 53 ensayos clínicos controlados utilizando diferentes epoetinas. El metanálisis de los datos de supervivencia general generó una estimación puntual del Hazard Ratio de 1,06 a favor de los controles (IC del 95%: 1,00-1,12; 53 estudios y 13,933 pacientes) y un Hazard Ratio de 1,04 para los pacientes con cáncer que reciben quimioterapia ( IC del 95%: 0,97-1,11; 38 estudios y 10 441 pacientes) El metanálisis también indica de forma coherente un aumento significativo del riesgo relativo de acontecimientos tromboembólicos en pacientes con cáncer que reciben eritropoyetina humana recombinante (ver sección 4.4).
05.2 Propiedades farmacocinéticas
Dado el mayor contenido de carbohidratos, el nivel circulante de darbepoetin alfa permanece por encima de la concentración mínima estimulante de la eritropoyesis durante más tiempo que la dosis equivalente molar de r-HuEPO, lo que permite una administración menos frecuente de darbepoetin alfa para lograr la misma respuesta biológica.
Pacientes con insuficiencia renal crónica
La farmacocinética de darbepoetin alfa se ha estudiado clínicamente en pacientes con insuficiencia renal crónica tras la administración intravenosa y subcutánea. La semivida terminal de darbepoetin alfa es de 21 horas (DE 7,5) cuando se administra por vía intravenosa. El aclaramiento de darbepoetin alfa es de 1,9 ml / hora / kg (DE 0,56) y el volumen de distribución en estado de equilibrio (Vss) es aproximadamente igual a el volumen plasmático (50 ml / kg). La biodisponibilidad es del 37% para la administración subcutánea. Después de la administración subcutánea mensual de darbepoetin alfa, a dosis de 0,6 a 2,1 μg / kg, la semivida terminal fue de 73 horas (DE 24). La cinética de absorción subcutánea da como resultado una "vida media terminal más prolongada de darbepoetin alfa cuando se administra por vía subcutánea que cuando se administra por vía intravenosa. En los estudios clínicos, se observó una acumulación mínima con ambas vías de administración. Los estudios preclínicos han demostrado que" el aclaramiento renal es mínimo (máximo 2% del aclaramiento total) y no afecta la vida media sérica.
Se analizaron los datos de 809 pacientes tratados con Aranesp en ensayos clínicos europeos para definir la dosis necesaria para mantener la hemoglobina; no se observó diferencia entre la dosis semanal media administrada por vía intravenosa o subcutánea.
Se evaluó la farmacocinética de darbepoetin alfa en pacientes pediátricos (2-16 años), con IRC tanto en diálisis como sin diálisis, para períodos de muestreo de hasta 2 semanas (336 horas) después de una o dos dosis subcutáneas o intravenosas. Utilizando la misma duración de muestreo, los datos farmacocinéticos observados y el modelo farmacocinético poblacional demostraron que el perfil farmacocinético de darbepoetin alfa era similar en pacientes con IRC pediátricos y adultos.
En un estudio farmacocinético de fase I, después de la administración intravenosa, se observó una diferencia de aproximadamente el 25% entre pacientes pediátricos y adultos para el área bajo la curva de 0 a infinito (AUC [0-∞]); sin embargo, esta diferencia fue menos del doble El rango de AUC [0-∞] observado en pacientes pediátricos. El AUC [0-∞] después de la administración subcutánea fue similar en pacientes adultos y pediátricos con IRC. La vida media también fue similar en pacientes adultos y pediátricos con IRC después de ambos administración intravenosa y subcutánea.
Pacientes con cáncer y sometidos a quimioterapia
Después de la administración subcutánea de 2,25 μg / kg a pacientes adultos con cáncer, se alcanzó una concentración máxima media de 10,6 ng / ml (DE 5,9) de darbepoetina alfa después de un tiempo medio de 91 horas (DE 19,7). Estos parámetros fueron consistentes con la farmacocinética lineal relacionada con la dosis en un amplio rango de dosis (0,5 a 8 mcg / kg semanalmente y 3 a 9 mcg / kg cada dos semanas). Los parámetros farmacocinéticos no cambiaron después de múltiples dosis durante 12 semanas (semanalmente o cada 2 semanas). Se esperaba un aumento moderado (
05.3 Datos preclínicos sobre seguridad
En todos los estudios en ratas y perros, darbepoetin alfa resultó en un aumento de hemoglobina, hematocrito, recuento de glóbulos rojos y reticulocitos, que correspondió a los efectos farmacológicos esperados. Los eventos adversos que ocurrieron en dosis muy altas se consideraron atribuibles a un efecto farmacológico exagerado (disminución de la perfusión tisular debido a "aumento de la viscosidad de la sangre). Estos eventos incluyen mielofibrosis, hipertrofia esplénica y también un alargamiento del complejo ECG-QRS en el" electrocardiograma en perros , pero no se observó arritmia ni efecto sobre el intervalo QT.
Darbepoetin alfa no mostró ningún potencial genotóxico ni tuvo ningún efecto sobre la proliferación. in vitro o en vivo de células no hematológicas. En los estudios de toxicidad crónica, no se observaron respuestas oncogénicas o mitogénicas inesperadas en ningún tipo de tejido. El potencial carcinogénico de darbepoetin alfa no se ha evaluado en estudios animales a largo plazo.
En estudios en ratas y conejos, no se observó evidencia clínicamente relevante de efectos adversos sobre el embarazo, desarrollo embrionario / fetal, parto o desarrollo posnatal.El pasaje transplacentario fue mínimo. No se observó deterioro de la fertilidad.
06.0 INFORMACIÓN FARMACÉUTICA
06.1 Excipientes
Fosfato de sodio monobásico
Fosfato de sodio dibásico
Cloruro de sodio
Polisorbato 80
Agua para preparaciones inyectables
06.2 Incompatibilidad
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos ni administrarse por perfusión con otros medicamentos.
06.3 Período de validez
3 años.
06.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 ° C y 8 ° C).
No congelar.
Mantenga el envase en el embalaje exterior para proteger el medicamento de la luz.
Para uso ambulatorio, Aranesp se puede mantener a temperatura ambiente (hasta 25 ° C) una sola vez y hasta siete días. Una vez que se ha sacado de la nevera y ha alcanzado la temperatura ambiente (hasta 25 ° C), debe utilizarse en un plazo de 7 días o desecharse.
06.5 Naturaleza del envase primario y contenido del envase.
Aranesp 10 microgramos solución inyectable en jeringa precargada.
0,4 ml de solución inyectable (25 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 15 microgramos solución inyectable en jeringa precargada.
0,375 ml de solución inyectable (40 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 20 microgramos solución inyectable en jeringa precargada.
0,5 ml de solución inyectable (40 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 30 microgramos solución inyectable en jeringa precargada.
0,3 ml de solución inyectable (100 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 40 microgramos solución inyectable en jeringa precargada.
0,4 ml de solución inyectable (100 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 50 mcg solución inyectable en jeringa precargada
0,5 ml de solución inyectable (100 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 60 microgramos solución inyectable en jeringa precargada.
0,3 ml de solución inyectable (200 μg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 80 microgramos solución inyectable en jeringa precargada.
0,4 ml de solución inyectable (200 μg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 100 microgramos solución inyectable en jeringa precargada.
0,5 ml de solución inyectable (200 μg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 130 microgramos solución inyectable en jeringa precargada.
0,65 ml de solución inyectable (200 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 150 microgramos solución inyectable en jeringa precargada.
0,3 ml de solución inyectable (500 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 300 microgramos solución inyectable en jeringa precargada.
0,6 ml de solución inyectable (500 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Aranesp 500 microgramos solución inyectable en jeringa precargada.
1 ml de solución inyectable (500 mcg / ml de darbepoetin alfa) en una jeringa precargada de vidrio tipo 1 con aguja de acero inoxidable de calibre 27. Envase de 1 o 4 jeringas precargadas.
Las jeringas se pueden envasar en blísters (envases de 1 y 4 jeringas), con o sin protector automático de la aguja, o sin blísters (envases de 1 jeringa solamente).
El capuchón de la aguja de la jeringa precargada contiene caucho natural seco (un derivado del látex) Ver sección 4.4.
Aranesp 10 microgramos solución inyectable en pluma precargada.
0,4 ml de solución inyectable (25 mcg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 15 microgramos solución inyectable en pluma precargada.
0,375 ml de solución inyectable (40 mcg / ml de darbepoetina alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 20 microgramos solución inyectable en pluma precargada.
0,5 ml de solución inyectable (40 mcg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 30 microgramos solución inyectable en pluma precargada.
0,3 ml de solución inyectable (100 mcg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 40 microgramos solución inyectable en pluma precargada.
0,4 ml de solución inyectable (100 μg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 50 mcg solución inyectable en pluma precargada
0,5 ml de solución inyectable (100 mcg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 60 microgramos solución inyectable en pluma precargada.
0,3 ml de solución inyectable (200 μg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 80 microgramos solución inyectable en pluma precargada.
0,4 ml de solución inyectable (200 μg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 100 mcg solución inyectable en pluma precargada
0,5 ml de solución inyectable (200 μg / ml de darbepoetina alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 130 mcg solución inyectable en pluma precargada
0,65 ml de solución inyectable (200 mcg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 150 microgramos solución inyectable en pluma precargada.
0,3 ml de solución inyectable (500 mcg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 300 mcg solución inyectable en pluma precargada
0,6 ml de solución inyectable (500 mcg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas.
Aranesp 500 mcg solución inyectable en pluma precargada
1 ml de solución inyectable (500 mcg / ml de darbepoetin alfa) en una pluma precargada con jeringa de vidrio tipo 1 y aguja de acero inoxidable de calibre 27. Envase de 1 o 4 plumas precargadas de Aranesp.
El capuchón de la aguja de la pluma precargada contiene caucho natural seco (un derivado del látex) Ver sección 4.4.
Aranesp 25 mcg solución inyectable en vial
1 ml de solución inyectable (25 mcg / ml de darbepoetin alfa) en un vial de vidrio tipo I con tapones de goma recubiertos de fluoropolímero y un sello de aluminio con desprendimiento de polvo. Envase de 1 o 4 viales.
Aranesp 40 mcg solución inyectable en vial
1 ml de solución inyectable (40 mcg / ml de darbepoetin alfa) en un vial de vidrio tipo I con tapones de goma recubiertos de fluoropolímero y un sello de aluminio con desprendimiento de polvo. Envase de 1 o 4 viales.
Aranesp 60 mcg solución inyectable en vial
1 ml de solución inyectable (60 mcg / ml de darbepoetina alfa) en un vial de vidrio tipo I con tapones de goma recubiertos de fluoropolímero y un sello de aluminio con desprendimiento de polvo. Envase de 1 o 4 viales.
Aranesp 100 mcg solución inyectable en vial
1 ml de solución inyectable (100 mcg / ml de darbepoetina alfa) en un vial de vidrio tipo I con tapones de goma recubiertos de fluoropolímero y un sello de aluminio con desprendimiento de polvo. Envase de 1 o 4 viales.
Aranesp 200 mcg solución inyectable en vial
1 ml de solución inyectable (200 mcg / ml de darbepoetin alfa) en un vial de vidrio tipo I con tapones de goma recubiertos de fluoropolímero y un sello de aluminio con desprendimiento de polvo. Envase de 1 o 4 viales.
Aranesp 300 mcg solución inyectable en vial
1 ml de solución inyectable (300 mcg / ml de darbepoetina alfa) en un vial de vidrio tipo I con tapones de goma recubiertos de fluoropolímero y un sello de aluminio con desprendimiento de polvo. Envase de 1 o 4 viales.
Es posible que no se comercialicen todos los tamaños de envases.
06.6 Instrucciones de uso y manipulación
La caja contiene un prospecto con instrucciones completas de uso y manipulación.
La pluma precargada de Aranesp (SureClick) administra la dosis completa para cada presentación.
Aranesp es un producto estéril pero no contiene conservantes. No administre más de una dosis. Cualquier cantidad de fármaco restante debe desecharse.
Antes de administrar la solución de Aranesp se debe comprobar la ausencia de partículas visibles. Solo se deben inyectar soluciones incoloras, transparentes o ligeramente opalescentes. No agitar. Dejar que el envase alcance la temperatura ambiente antes de inyectar la solución.
Los medicamentos no utilizados y los desechos derivados de este medicamento deben eliminarse de acuerdo con las regulaciones locales.
07.0 TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Amgen Europe B.V.
Minervum 7061
NL-4817 ZK Breda
Países Bajos
08.0 NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Aranesp 10 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/001 1 pieza con blister
EU / 1/01/185/002 4 piezas con blíster
EU / 1/01/185/033 1 pieza sin blíster
EU / 1/01/185/074 1 pieza con blíster con protección de aguja
EU / 1/01/185/075 4 piezas con blíster con protección de aguja
Aranesp 15 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/003 1 pieza con blister
EU / 1/01/185/004 4 piezas con blíster
EU / 1/01/185/034 1 pieza sin blíster
EU / 1/01/185/076 1 pieza con blister con protección de aguja
EU / 1/01/185/077 4 piezas con blíster con protección de aguja
Aranesp 20 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/005 1 pieza con blister
EU / 1/01/185/006 4 piezas con blíster
EU / 1/01/185/035 1 pieza sin blister
EU / 1/01/185/078 1 pieza con blister con protección de aguja
EU / 1/01/185/079 4 piezas con blíster con protección de aguja
Aranesp 30 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/007 1 pieza con blíster
EU / 1/01/185/008 4 piezas con blíster
EU / 1/01/185/036 1 pieza sin blister
EU / 1/01/185/080 1 pieza con blíster con protección de aguja
EU / 1/01/185/081 4 piezas con blíster con protección de aguja
Aranesp 40 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/009 1 pieza con blister
EU / 1/01/185/010 4 piezas con blíster
EU / 1/01/185/037 1 pieza sin blíster
EU / 1/01/185/082 1 pieza con blister con protección de aguja
EU / 1/01/185/083 4 piezas con blíster con protección de aguja
Aranesp 50 mcg solución inyectable en jeringa precargada
EU / 1/01/185/011 1 pieza con blister
EU / 1/01/185/012 4 piezas con blíster
EU / 1/01/185/038 1 pieza sin blíster
EU / 1/01/185/084 1 pieza con blister con protección de aguja
EU / 1/01/185/085 4 piezas con blíster con protección de aguja
Aranesp 60 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/013 1 pieza con blister
EU / 1/01/185/014 4 piezas con blíster
EU / 1/01/185/039 1 pieza sin blister
EU / 1/01/185/086 1 pieza con blister con protección de aguja
EU / 1/01/185/087 4 piezas con blíster con protección de aguja
Aranesp 80 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/015 1 pieza con blister
EU / 1/01/185/016 4 piezas con blíster
EU / 1/01/185/040 1 pieza sin blíster
EU / 1/01/185/088 1 pieza con blíster con protección de aguja
EU / 1/01/185/089 4 piezas con blíster con protección de aguja
Aranesp 100 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/017 1 pieza con blister
EU / 1/01/185/018 4 piezas con blíster
EU / 1/01/185/041 1 pieza sin blíster
EU / 1/01/185/090 1 pieza con blister con protección de aguja
EU / 1/01/185/091 4 piezas con blíster con protección de aguja
Aranesp 130 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/069 1 pieza con blister
EU / 1/01/185/070 4 piezas con blíster
EU / 1/01/185/071 1 pieza sin blíster
EU / 1/01/185/092 1 pieza con blister con protección de aguja
EU / 1/01/185/093 4 piezas con blíster con protección de aguja
Aranesp 150 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/019 1 pieza con blister
EU / 1/01/185/020 4 piezas con blíster
EU / 1/01/185/042 1 pieza sin blíster
EU / 1/01/185/094 1 pieza con blíster con protección de aguja
EU / 1/01/185/095 4 piezas con blíster con protección de aguja
Aranesp 300 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/021 1 pieza con blister
EU / 1/01/185/022 4 piezas con blíster
EU / 1/01/185/043 1 pieza sin blister
EU / 1/01/185/096 1 pieza con blíster con protección de aguja
EU / 1/01/185/097 4 piezas con blíster con protección de aguja
Aranesp 500 microgramos solución inyectable en jeringa precargada.
EU / 1/01/185/031 1 pieza con blister
EU / 1/01/185/032 4 piezas con blíster
EU / 1/01/185/044 1 pieza sin blíster
EU / 1/01/185/098 1 pieza con blíster con protección de aguja
EU / 1/01/185/099 4 piezas con blíster con protección de aguja
Aranesp 10 microgramos solución inyectable en pluma precargada.
EU / 1/01/185/045 1 pieza
EU / 1/01/185/057 4 piezas
Aranesp 15 microgramos solución inyectable en pluma precargada.
EU / 1/01/185/046 1 pieza
EU / 1/01/185/058 4 piezas
Aranesp 20 microgramos solución inyectable en pluma precargada.
EU / 1/01/185/047 1 pieza
EU / 1/01/185/059 4 piezas
Aranesp 30 microgramos solución inyectable en pluma precargada.
EU / 1/01/185/048 1 pieza
EU / 1/01/185/060 4 piezas
Aranesp 40 microgramos solución inyectable en pluma precargada.
EU / 1/01/185/049 1 pieza
EU / 1/01/185/061 4 piezas
Aranesp 50 mcg solución inyectable en pluma precargada
EU / 1/01/185/050 1 pieza
EU / 1/01/185/062 4 piezas
Aranesp 60 microgramos solución inyectable en pluma precargada.
EU / 1/01/185/051 1 pieza
EU / 1/01/185/063 4 piezas
Aranesp 80 microgramos solución inyectable en pluma precargada.
EU / 1/01/185/052 1 pieza
EU / 1/01/185/064 4 piezas
Aranesp 100 mcg solución inyectable en pluma precargada
EU / 1/01/185/053 1 pieza
EU / 1/01/185/065 4 piezas
Aranesp 130 mcg solución inyectable en pluma precargada
EU / 1/01/185/072 1 pieza
EU / 1/01/185/073 4 piezas
Aranesp 150 microgramos solución inyectable en pluma precargada.
EU / 1/01/185/054 1 pieza
EU / 1/01/185/066 4 piezas
Aranesp 300 mcg solución inyectable en pluma precargada
EU / 1/01/185/055 1 pieza
EU / 1/01/185/067 4 piezas
Aranesp 500 mcg solución inyectable en pluma precargada
EU / 1/01/185/056 1 pieza
EU / 1/01/185/068 4 piezas
Aranesp 25 mcg solución inyectable en vial
EU / 1/01/185/100 1 pieza
EU / 1/01/185/101 4 piezas
Aranesp 40 mcg solución inyectable en vial
EU / 1/01/185/102 1 pieza
EU / 1/01/185/103 4 piezas
Aranesp 60 mcg solución inyectable en vial
EU / 1/01/185/104 1 pieza
EU / 1/01/185/105 4 piezas
Aranesp 100 mcg solución inyectable en vial
EU / 1/01/185/106 1 pieza
EU / 1/01/185/107 4 piezas
Aranesp 200 mcg solución inyectable en vial
EU / 1/01/185/108 1 pieza
EU / 1/01/185/109 4 piezas
Aranesp 300 mcg solución inyectable en vial
EU / 1/01/185/110 1 pieza
EU / 1/01/185/111 4 piezas
035691017
035691029
035691031
035691043
035691056
035691068
035691070
035691082
035691094
035691106
035691118
035691120
035691132
035691144
035691157
035691169
035691171
035691183
035691195
035691207
035691219
035691221
035691310
035691322
035691334
035691346
035691359
035691361
035691373
035691385
035691397
035691409
035691411
035691423
035691435
035691447
035691536
035691548
035691551
035691563
035691575
035691587
035691599
035691601
035691613
035691625
035691637
035691649
035691652
035691664
035691676
035691688
035691690
035691702
035691714
035691726
035691738
035691740
035691753
035691765
035691777
035691789
09.0 FECHA DE LA PRIMERA AUTORIZACIÓN O RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 8 de junio de 2001
Fecha de la última renovación: 19 de mayo de 2006
10.0 FECHA DE REVISIÓN DEL TEXTO
Septiembre de 2015