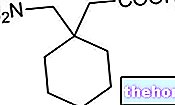
Ingredientes activos: Doxiciclina
Efracea 40 mg cápsulas duras de liberación modificada
¿Por qué se usa Efracea? ¿Para qué sirve?
Efracea es un medicamento que contiene el principio activo doxiciclina. Se usa en adultos para reducir las espinillas rojas o espinillas en la cara causadas por una enfermedad llamada rosácea.
Contraindicaciones cuando no se debe usar Efracea
No tome Efracea
- si es alérgico (hipersensible) a alguno de los medicamentos de la familia de las tetraciclinas, incluidas la doxiciclina o la minociclina, oa cualquiera de los demás componentes de este medicamento (incluidos en la sección 6.)
- Si está embarazada, no debe utilizar Oracea a partir del 4º mes de embarazo, ya que puede dañar al feto. Si sospecha o se entera de que está embarazada mientras toma Efracea, comuníquese con su médico de inmediato.
- en combinación con retinoides (medicamentos utilizados para tratar determinadas afecciones de la piel como el acné severo) administrados por vía oral (ver sección "Otros medicamentos y Oracea").
- si padece una enfermedad que provoca la ausencia de ácido del estómago (aclorhidria) o si ha sido sometido a una cirugía en el primer tracto intestinal (duodeno).
Los bebés o niños menores de 12 años no deben tomar Efracea, ya que puede causar una decoloración permanente de los dientes o problemas con el desarrollo dental.
Precauciones de uso Lo que necesita saber antes de tomar Efracea
Consulte a su médico o farmacéutico antes de tomar Oracea si:
- sufre de enfermedad hepática
- tiene antecedentes de predisposición a la proliferación de candidiasis o si padece una candidiasis oral o vaginal o una infección por hongos
- sufre una enfermedad muscular llamada miastenia gravis
- sufre de colitis
- sufre irritación o úlcera esofágica
- sufre del tipo de rosácea que afecta a los ojos
- expone su piel a la luz solar intensa o la luz solar artificial, ya que algunas personas que toman doxiciclina pueden sufrir quemaduras solares graves. Considere usar un protector solar o protector solar para reducir el riesgo de quemaduras solares y deje de usar Efracea si tiene quemaduras solares.
Interacciones ¿Qué medicamentos o alimentos pueden modificar el efecto de la Oracea?
Otros medicamentos y Oracea
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Es posible que la Oracea y algunos otros medicamentos no funcionen correctamente cuando se toman juntos. Informe a su médico sobre cualquier medicamento que tome o planee tomar mientras toma Efracea.
- Efracea no debe usarse al mismo tiempo que isotretinoína debido al riesgo de aumento de la presión cerebral. La isotretinoína se prescribe a pacientes con afecciones graves de acné.
- No tome antiácidos, multivitaminas u otros productos que contengan calcio (como leche y productos lácteos o jugos de frutas que contengan calcio), aluminio, magnesio (incluidas las tabletas de quinapril que se toman para la presión arterial alta), hierro o bismuto, o colestiramina. , carbón activado o sucralfato hasta 2-3 horas después de tomar Efracea Estos medicamentos pueden reducir la efectividad de Efracea cuando se toman al mismo tiempo.
- Otros tratamientos para las úlceras o la acidez de estómago también pueden reducir la eficacia de Efracea y no deben tomarse hasta al menos 2 horas después de Efracea.
- Si está tomando anticoagulantes, su médico puede encontrar que es necesario cambiar la dosis de su anticoagulante.
- Si está tomando determinados medicamentos para la diabetes, es posible que su médico pueda comprobar si es necesario modificar la dosis de estos medicamentos.
- Existe la posibilidad de que Efracea reduzca la eficacia de los anticonceptivos orales, provocando un embarazo.
- Efracea puede hacer que ciertos antibióticos, incluidas las penicilinas, sean menos efectivos.
- Tomar barbitúricos (pastillas para dormir o analgésicos de corta duración), rifampicina (tuberculosis), carbamazepina (epilepsia), difenilhidantoína y fenitoína (convulsiones cerebrales), primidona (anticonvulsivante) o ciclosporina (trasplantes de órganos) puede acortar la duración de la actividad de Oracea. en su organismo.
- El uso de Efracea con el anestésico general metoxifluorano puede causar daño renal severo.
Toma de Oracea con alimentos y bebidas
Siempre tome Efracea con una cantidad adecuada de agua para humedecer la cápsula, ya que esto reduce el riesgo de irritación o ulceración en la garganta o el esófago.
No tome leche o productos lácteos al mismo tiempo que Efracea, ya que estos productos contienen calcio que puede reducir la eficacia de Efracea. Permita 2-3 horas después de tomar la dosis diaria de Efracea antes de beber o comer productos lácteos.
Advertencias Es importante saber que:
Embarazo y lactancia
Efracea no debe usarse durante el embarazo ya que puede causar una decoloración permanente de los dientes en el feto.
Las madres que están amamantando no deben usar Efracea durante períodos prolongados, ya que el medicamento puede causar una decoloración anormal de los dientes y reducir el crecimiento óseo en el bebé.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
La influencia de Oracea sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Efracea contiene azúcar (sacarosa) y Allura Red AC - laca de aluminio (E129). Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
La tinta utilizada para imprimir en las cápsulas contiene Rojo Allura AC - laca de aluminio (E129) que puede provocar reacciones alérgicas.
Dosis, método y momento de administración Cómo usar Efracea: Posología
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte a su médico o farmacéutico.
La dosis recomendada es una cápsula de Oracea al día por la mañana. Trague la cápsula entera, sin masticarla.
Debe tomar Efracea con un vaso lleno de agua en posición sentada o de pie para evitar cualquier irritación de la garganta.
Sobredosis Qué hacer si ha tomado demasiada Oracea
Si toma más Oracea del que debiera
Si toma una sobredosis de Efracea, existe el riesgo de que se produzcan daños en el hígado, los riñones o el páncreas.
Si toma más cápsulas de Oracea de las que debiera, consulte a su médico inmediatamente.
Si olvidó tomar Efracea
No tome una dosis doble para compensar las cápsulas olvidadas.
Si deja de tomar Oracea
Debe seguir tomando Efracea hasta que su médico decida interrumpirlo.
Si tiene más preguntas sobre el uso de este medicamento, consulte a su médico o farmacéutico.
Efectos secundarios ¿Cuáles son los efectos secundarios de la Oracea?
Como todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos secundarios comunes
Los siguientes efectos adversos pueden ocurrir con frecuencia (afectan de 1 a 10 de cada 100 pacientes) durante el tratamiento con Efracea:
- Inflamación de la nariz y la garganta.
- Inflamación de los senos nasales (sinusitis)
- Infecciones por hongos
- Ansiedad
- Dolor de cabeza por sinusitis
- Presión arterial alta o aumentada
- Diarrea
- Dolor en la parte superior del abdomen
- Boca seca
- Dolor de espalda
- Dolor
- Cambios en algunos análisis de sangre (cantidad de azúcar en sangre o pruebas de función hepática).
Reacciones adversas con frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Los siguientes efectos secundarios pueden ocurrir durante el tratamiento con Efracea:
- aumento de la presión cerebral
- dolor de cabeza
Efectos secundarios raros
Los siguientes efectos adversos pueden ocurrir con poca frecuencia (que afectan de 1 a 10 usuarios de cada 10.000) durante el tratamiento con la clase de medicamentos a los que pertenece Efracea (las tetraciclinas):
- Reacción alérgica (hipersensibilidad) en todo el cuerpo *
- Cambios en la cantidad o tipo de algunas células sanguíneas en la sangre.
- Aumento de la presión cerebral
- Inflamación de la membrana que rodea el corazón.
- Náuseas, vómitos, diarrea, anorexia.
- Daño hepático
- Erupciones cutáneas o urticaria
- Reacción anormal de la piel a la luz solar.
- Aumento del nivel de urea en sangre.
Efectos secundarios muy raros
Los siguientes efectos adversos pueden ocurrir muy raramente (afectando a menos de 1 de cada 10.000 pacientes) durante el tratamiento con la clase de medicamentos a los que pertenece Efracea (las tetraciclinas):
- Reacción alérgica que causa hinchazón de los ojos, labios o lengua *
- Infección por hongos alrededor del ano o los genitales.
- Cambios en los glóbulos rojos (anemia hemolítica)
- Con el uso prolongado de tetraciclinas, se han observado manchas microscópicas de color marrón negruzco en los tejidos tiroideos y la función tiroidea es normal.
- Aumento de la presión intracraneal en recién nacidos.
- Inflamación de la lengua
- Dificultad para tragar
- Inflamación del intestino
- Inflamación o úlcera del esófago.
- Inflamación de la piel que provoca descamación.
- Empeoramiento de la enfermedad del sistema inmunológico conocida como lupus eritematoso sistémico (LES)
Reacciones adversas con frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Los siguientes efectos secundarios pueden ocurrir durante el tratamiento con la clase de medicamentos a los que pertenece EFRACEA (las tetraciclinas):
- desprendimiento de la uña del lecho ungueal después de la exposición al sol.
* Consulte a su médico de inmediato o acuda al servicio de urgencias más cercano si nota efectos secundarios como hinchazón de la cara, labios, lengua y garganta, dificultad para respirar, urticaria o picazón en la piel y los ojos, o latidos cardíacos rápidos (palpitaciones) y sensación. de debilidad. Estos efectos pueden ser síntomas de una reacción alérgica (hipersensibilidad) grave.
Notificación de efectos secundarios
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluidos los posibles efectos adversos que no aparecen en este prospecto. También puede informar los efectos secundarios directamente a través de la Agencia Italiana de Medicamentos, sitio web: http://www.agenziafarmaco.gov.it/ Al informar los efectos secundarios, puede ayudar a proporcionar más información sobre la seguridad de este medicamento.
Caducidad y retención
Mantenga este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y el blister después de "CAD". La fecha de vencimiento se refiere al último día de ese mes.
Almacenar en el paquete original para mantenerlo alejado de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita, ya que esto ayudará a proteger el medio ambiente.
Composición y forma farmacéutica
Qué contiene Efracea
- El ingrediente activo es la doxiciclina. Cada cápsula contiene 40 mg de doxiciclina (como monohidrato).
- Los demás componentes son:
Hipromelosa, copolímero de ácido metacrílico-acrilato de etilo (1: 1), citrato de trietilo, talco, hipromelosa, dióxido de titanio, macrogol 400, óxido de hierro amarillo, óxido de hierro rojo, polisorbato 80, esferas de azúcar (almidón de maíz, sacarosa).
Cápsulas: gelatina, óxido de hierro negro, óxido de hierro rojo, óxido de hierro amarillo, dióxido de titanio
Tinta de impresión: goma laca, propilenglicol, óxido de hierro negro, Carmín índigo - laca de aluminio, Rojo Allura AC - laca de aluminio (E129), Azul brillante FCF - laca de aluminio, Amarillo D&C No. 10 - laca de aluminio.
Consulte el final de la sección 2 para obtener información sobre el azúcar (sacarosa) y el rojo Allura AC - laca de aluminio (E129).
Aspecto de Oracea y contenido del envase
Efracea es una cápsula dura de liberación modificada.
Las cápsulas son de color beige y llevan la indicación "GLD 40".
Oracea está disponible en envases de 56, 28 o 14 cápsulas (es posible que no se comercialicen todos los tamaños de envases).
Prospecto fuente: AIFA (Agencia Italiana de Medicamentos). Contenido publicado en enero de 2016. Es posible que la información presente no esté actualizada.
Para tener acceso a la versión más actualizada, es recomendable acceder al sitio web de la AIFA (Agencia Italiana de Medicamentos). Descargo de responsabilidad e información útil.
01.0 NOMBRE DEL MEDICAMENTO
EFRACEA 40 MG CÁPSULAS DE LIBERACIÓN MODIFICADA DURA
02.0 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula contiene 40 mg de doxiciclina (como monohidrato).
Excipientes con efectos conocidos: 102-150 mg de sacarosa y 26,6 - 29,4 mcg de Rosso Allura AC - laca de aluminio (E129).
Para consultar la lista completa de excipientes, ver sección 6.1.
03.0 FORMA FARMACÉUTICA
Cápsula de liberación modificada, dura.
Cápsula beige, tamaño N. 2, con la indicación "GLD 40".
04.0 INFORMACIÓN CLÍNICA
04.1 Indicaciones terapéuticas
Efracea está indicado para la reducción de lesiones papulopustulosas en pacientes adultos con rosácea facial.
04.2 Posología y forma de administración
Dosis
Adultos, incluidos los ancianos:
Uso oral
La dosis diaria es de 40 mg (1 cápsula).
Pacientes con insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal.
Pacientes con insuficiencia hepática
Oracea debe administrarse con precaución en pacientes con insuficiencia hepática o en aquellos que toman medicamentos potencialmente hepatotóxicos (ver sección 4.4).
Población pediátrica
Oracea está contraindicado en niños menores de 12 años (ver sección 4.3).
Método de administración
La cápsula debe tomarse por la mañana con una cantidad adecuada de agua para reducir el riesgo de irritación y úlcera esofágica (ver sección 4.4).
Los pacientes deben ser evaluados después de 6 semanas y, en ausencia de resultados, debe considerarse la posibilidad de suspender el tratamiento. En los ensayos clínicos, los pacientes fueron tratados durante 16 semanas. Al suspender el tratamiento, las lesiones tendieron a reaparecer en la visita 4 semanas de seguimiento. -up, por lo que se recomienda reevaluar a los pacientes 4 semanas después de la interrupción del tratamiento.
04.3 Contraindicaciones
Hipersensibilidad al principio activo, a otras tetraciclinas oa alguno de los excipientes incluidos en la sección 6.1.
Bebés y niños hasta 12 años.
Segundo y tercer trimestre del embarazo (ver sección 4.6).
Administración concomitante de retinoides orales (ver sección 4.5).
No se debe prescribir doxiciclina a pacientes con aclorhidria conocida o sospechada, o que se hayan sometido a una derivación duodenal o una cirugía de derivación.
04.4 Advertencias especiales y precauciones de uso apropiadas
Efracea contiene doxiciclina en una formulación diseñada para producir niveles plasmáticos antiinflamatorios por debajo del umbral antimicrobiano. Efracea no debe usarse para tratar infecciones causadas por organismos sensibles (o sospechosos de serlo) a la doxiciclina.
Las formas de dosificación sólidas de tetraciclinas pueden causar irritación y úlcera esofágica. Para evitar la irritación y la úlcera esofágica, tome el medicamento con una cantidad adecuada de líquido (agua) (ver sección 4.2). La Oracea debe ingerirse en posición erguida, sentada o de pie.
Aunque no se observó proliferación de microorganismos oportunistas, como las levaduras, durante los estudios clínicos con Efracea, las terapias basadas en tetraciclina en dosis más altas pueden conducir a la proliferación de microorganismos no sensibles, incluidos los hongos. Aunque no se observó en los ensayos clínicos con Efracea, el uso de tetraciclinas en dosis más altas puede aumentar la incidencia de candidiasis vaginal. Oracea debe usarse con precaución en pacientes con antecedentes de predisposición a la proliferación de candidiasis. Si se sospecha de sobreinfección, tome las medidas adecuadas, incluida la posibilidad de interrumpir el tratamiento con Efracea.
El tratamiento con dosis más altas de tetraciclinas se asocia con la aparición de bacterias intestinales resistentes, como enterococos y enterobacterias. Aunque no se observó en los ensayos clínicos con dosis bajas de doxiciclina (40 mg / día), no se puede excluir el riesgo de desarrollo de resistencia en la microflora normal en pacientes tratados con Efracea.
Los niveles sanguíneos de doxiciclina en pacientes tratados con Efracea son más bajos que aquellos tratados con formulaciones antimicrobianas convencionales de doxiciclina. Sin embargo, dado que no existen datos de seguridad con respecto al uso de esta dosis más baja en la insuficiencia hepática, Oracea debe administrarse con precaución en pacientes con insuficiencia hepática o en aquellos que reciben medicamentos potencialmente hepatotóxicos. La acción antianabólica de las tetraciclinas puede causar un aumento en la sangre. nitrógeno ureico: Los estudios realizados hasta la fecha indican que este fenómeno no ocurre con el uso de doxiciclina en pacientes con insuficiencia renal.
Se debe tener precaución al tratar a pacientes con miastenia gravis, ya que esta condición puede empeorar.
Se aconseja a todos los pacientes en terapia con doxiciclina, incluida Efracea, que eviten la exposición excesiva al sol o luz ultravioleta artificial mientras toman doxiciclina y que interrumpan la terapia en caso de fototoxicidad (erupción cutánea, etc.). Se debe considerar el uso de protector solar o bloqueador solar El tratamiento debe suspenderse ante los primeros signos de fotosensibilidad.
Al igual que con todos los medicamentos antimicrobianos en general, existe el riesgo de desarrollar colitis pseudomembranosa durante el tratamiento con doxiciclina. En caso de episodios de diarrea durante el tratamiento con Efracea, se debe considerar la posibilidad de colitis pseudomembranosa e instaurar el tratamiento. Esto puede incluir la interrupción de la doxiciclina. e instituir una terapia antibiótica específica. En tales situaciones, no deben emplearse agentes inhibidores de la peristalsis.
No utilice Oracea en pacientes con lesiones oculares por rosácea (como rosácea ocular y / o blefaritis / meibomianitis) ya que existen datos limitados de eficacia y seguridad para este tipo de población. Si estas manifestaciones aparecen durante el curso del tratamiento, interrumpa el tratamiento con Efracea y derive al paciente a un oftalmólogo.
En los seres humanos, el uso de tetraciclinas durante el desarrollo dental puede provocar una decoloración permanente de los dientes (amarillo-gris-marrón). Esta reacción es más común con el uso prolongado del medicamento, pero también se ha observado después de tratamientos repetidos a corto plazo. También se ha informado la posibilidad de hipoplasia del esmalte.Al igual que con otras tetraciclinas, la doxiciclina forma un complejo estable con calcio en cualquier tejido que contenga osteoblastos. Se observó una disminución en el crecimiento del peroné en los bebés prematuros que tomaban tetraciclina oral en dosis de 25 mg / kg cada 6 horas, reacción que fue reversible después de suspender el medicamento.
En caso de una reacción de hipersensibilidad aguda grave (por ejemplo, anafilaxia), suspenda el tratamiento con Oracea inmediatamente y tome las medidas de emergencia habituales (por ejemplo, administración de antihistamínicos, corticosteroides, simpaticomiméticos y, si es necesario, respiración artificial).
Los pacientes con problemas hereditarios raros de intolerancia a la fructosa, malabsorción de glucosa-galactosa o insuficiencia de sacarasa-isomaltasa no deben tomar este medicamento.
La tinta de impresión de las cápsulas contiene Rojo Allura AC - laca de aluminio (E129) que puede provocar reacciones alérgicas.
04.5 Interacciones con otros medicamentos y otras formas de interacción
Las recomendaciones siguientes con respecto a las posibles interacciones entre la doxiciclina y otros medicamentos se basan en la experiencia posterior al uso de dosis más altas generalmente utilizadas en las formulaciones antimicrobianas de doxiciclina en lugar de las de Efracea. Sin embargo, en la actualidad, no hay datos suficientes para asegurar que las interacciones descritas con dosis más altas de doxiciclina no ocurrirán también con Efracea.
Interacciones relacionadas con la doxiciclina:
La absorción de doxiciclina del tracto gastrointestinal puede ser inhibida por iones bivalentes o trivalentes como aluminio, zinc, calcio (que se encuentran por ejemplo en la leche y derivados o en jugos de frutas que contienen calcio), por magnesio (presente por ejemplo en antiácidos) o a partir de preparados a base de hierro, carbón activado, colestiramina, quelatos de bismuto y sucralfato, por lo que estos medicamentos o alimentos deben tomarse unas 2-3 horas después de la toma de doxiciclina.
Los medicamentos que aumentan el pH gástrico pueden reducir la absorción de doxiciclina, por lo que deben tomarse al menos 2 horas después de tomar doxiciclina.
El quinapril puede reducir la absorción de doxiciclina, debido al alto contenido de magnesio presente en las tabletas de quinapril.
La rifampicina, los barbitúricos, la carbamazepina, la difenilhidantoína, la primidona, la fenitoína y el abuso crónico de alcohol pueden acelerar la degradación de la doxiciclina después de la inducción de enzimas en el hígado, reduciendo así su vida media y dando lugar a concentraciones subterapéuticas de doxiciclina.
Se ha informado que el uso concomitante de ciclosporina reduce la vida media de la doxiciclina.
Interacciones relacionadas con otros medicamentos:
No se recomienda el uso concomitante:
Cuando se administra doxiciclina poco antes, durante o después de los ciclos de isotretinoína, existe la posibilidad de potenciación entre fármacos que puede conducir a un aumento reversible de la presión intracraneal (hipertensión intracraneal). Por tanto, debe evitarse la administración concomitante.
Los medicamentos bacteriostáticos, incluida la doxiciclina, pueden interferir con la acción bactericida de la penicilina y los antibióticos betalactámicos, por lo que se recomienda no utilizar la doxiciclina y los antibióticos betalactámicos en combinación.
Otras interacciones:
Se ha informado que el uso combinado de tetraciclinas y metoxiflurano conduce a una nefrotoxicidad mortal.
Se ha demostrado que la doxiciclina potencia el efecto hipoglucemiante de los antidiabéticos de sulfonilureas orales. Cuando se administra en combinación con estos fármacos, se deben controlar los niveles de glucosa en sangre y, si es necesario, reducir las dosis de sulfonilurea.
Se ha demostrado que la doxiciclina deprime la actividad de la protrombina plasmática, lo que potencia el efecto de los anticoagulantes de tipo dicumarol. Cuando se administra en combinación con dichos agentes, deben controlarse los parámetros de coagulación, incluido el INR (índice internacional normalizado), y deben reducirse las dosis de los medicamentos anticoagulantes si es necesario. Siempre debe considerarse la posibilidad de un aumento de la coagulación sanguínea. Riesgo de hemorragia.
Las tetraciclinas utilizadas concomitantemente con anticonceptivos orales han provocado en algunos casos hemorragia o embarazo.
04.6 Embarazo y lactancia
El embarazo
Los estudios en animales no han mostrado un efecto teratogénico En humanos, el uso de tetraciclinas en un número limitado de embarazos no ha dado lugar a ninguna malformación específica hasta la fecha.
La administración de tetraciclinas durante el segundo y tercer trimestre conduce a una decoloración permanente de los dientes temporales en el feto. En consecuencia, la doxiciclina está contraindicada durante el segundo y tercer trimestre del embarazo (ver sección 4.3).
Hora de la comida
Los niveles bajos de tetraciclinas se excretan en la leche materna. Las madres que amamantan solo pueden usar doxiciclina durante períodos cortos. El uso prolongado de doxiciclina puede provocar una absorción significativa por parte del bebé y, por lo tanto, no se recomienda debido a los riesgos teóricos de decoloración de los dientes y crecimiento óseo reducido para el bebé.
Fertilidad
La administración oral de doxiciclina a ratas Sprague-Dawley machos y hembras tuvo efectos adversos sobre la fertilidad y la función reproductora (ver sección 5.3).
Se desconocen los efectos de la Oracea sobre la fertilidad humana.
04.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Oracea sobre la capacidad para conducir o utilizar máquinas es nula o insignificante.
04.8 Efectos indeseables
Resumen del perfil de seguridad
En los estudios piloto controlados con placebo sobre el uso de Oracea en el curso de la rosácea, 269 pacientes fueron tratados con Oracea 40 mg una vez al día y 268 pacientes con placebo durante 16 semanas. Las reacciones adversas gastrointestinales ocurrieron en general en una mayor proporción de pacientes que tomaban Oracea. (13,4%) en comparación con los que tomaron placebo (8,6%). Las reacciones adversas notificadas con mayor frecuencia en pacientes tratados con Efracea, es decir, las que ocurrieron con una frecuencia ≥3% en el grupo con Efracea y con una frecuencia de al menos 1% mayor que el placebo, fueron nasofaringitis, diarrea e hipertensión.
Lista tabular de reacciones adversas
La siguiente tabla enumera las reacciones adversas a Efracea en los estudios clínicos pivotales, es decir, las reacciones adversas para las cuales la frecuencia en el grupo de Efracea fue mayor que la frecuencia en el grupo de placebo (en ≥1%).
Las reacciones adversas notificadas para los antibióticos de tetraciclina como clase se enumeran después de la tabla. Las reacciones adversas se clasifican por órganos del sistema y frecuencia, utilizando las siguientes convenciones: muy frecuentes (> 1/10), frecuentes (> 1/100, 1 / 1.000, 1 / 10.000,
Tabla 1 - Reacciones adversas a la Oracea en los estudios piloto controlados con placebo en la rosácea:
a Definidos como eventos adversos en los que la frecuencia en el grupo de Oracea fue mayor que en el grupo de placebo (al menos en un 1%)
Se han notificado casos de hipertensión intracraneal benigna y dolor de cabeza (frecuencia no conocida: no estimada a partir de los datos disponibles) durante la vigilancia poscomercialización de Efracea.
Se han observado las siguientes reacciones adversas en pacientes que toman tetraciclinas:
Infecciones e infestaciones:
Muy raras: candidiasis anogenital.
Trastornos del sistema sanguíneo y linfático:
Raras: trombocitopenia, neutropenia, eosinofilia
Muy raras: anemia hemolítica.
Trastornos del sistema inmunológico:
Raras: reacciones de hipersensibilidad, incluida anafilaxia.
También ha habido casos de: púrpura anafilactoide
Desordenes endocrinos:
Muy raras: se han observado manchas microscópicas de color marrón-negro en los tejidos tiroideos con el uso prolongado de tetraciclinas. La función tiroidea es normal.
Trastornos del sistema nervioso:
Raras: hipertensión intracraneal benigna
Muy raras: hinchazón de las fontanelas en los recién nacidos.
El tratamiento debe suspenderse si se produce un aumento de la presión intracraneal. Estos efectos desaparecieron rápidamente con la interrupción del tratamiento.
Trastornos cardíacos:
Raras: pericarditis.
Desórdenes gastrointestinales:
Raras: náuseas, vómitos, diarrea, anorexia.
Muy raras: glositis, disfagia, enterocolitis. Se han observado esofagitis y úlceras esofágicas, con mayor frecuencia en pacientes que recibieron sal de hyclate en forma de cápsulas. La mayoría de estos pacientes tomaron el medicamento inmediatamente antes de acostarse.
Trastornos hepatobiliares:
Raras: hepatotoxicidad
Trastornos de la piel y del tejido subcutáneo:
Raras: erupción maculopapular y eritematosa, fotosensibilidad cutánea, urticaria.
Muy raras: dermatitis exfoliativa, edema angioneurótico.
Frecuencia no conocida: fotoonicólisis.
Trastornos musculoesqueléticos y del tejido conjuntivo:
Muy raras: exacerbación del lupus eritematoso sistémico.
Trastornos renales y urinarios:
Raras: BUN aumentado.
Es menos probable que se produzcan reacciones adversas típicas de la clase de medicamentos de las tetraciclinas durante el tratamiento con Efracea debido a la dosis reducida y los niveles plasmáticos relativamente bajos implicados. Sin embargo, el médico siempre debe tener en cuenta la posibilidad de que ocurran eventos adversos y debe monitorear adecuadamente a los pacientes.
Notificación de sospechas de reacciones adversas
La notificación de sospechas de reacciones adversas que se produzcan después de la autorización del medicamento es importante, ya que permite un seguimiento continuo de la relación beneficio / riesgo del medicamento.Se invita a los profesionales sanitarios a notificar cualquier sospecha de reacciones adversas a través de la Agencia Italiana de Medicamentos. , sitio web: http://www.agenziafarmaco.gov.it/it/responsabili
04.9 Sobredosis
Síntomas
Hasta la fecha, no se han descrito fenómenos de toxicidad aguda significativos en el caso de una sola ingesta oral de una dosis terapéutica múltiple de doxiciclina. En caso de sobredosis, sin embargo, existe el riesgo de daño del parénquima hepático y renal y pancreatitis.
Tratamiento
La dosis habitual de Efracea es menos de la mitad de la dosis habitual de doxiciclina utilizada para la terapia antimicrobiana. Por tanto, los médicos deben considerar que, en muchos casos, es probable que una sobredosis dé lugar a concentraciones sanguíneas de doxiciclina dentro del rango terapéutico para el tratamiento antimicrobiano, para lo cual existe una gran cantidad de datos que confirman la seguridad del medicamento. "Observación del paciente. En casos de sobredosis significativa, se debe interrumpir inmediatamente el tratamiento con doxiciclina y tomar las medidas sintomáticas necesarias.
La absorción intestinal de la doxiciclina no absorbida debe minimizarse mediante la administración de antiácidos que contengan sales de magnesio o calcio para producir quelatos complejos con doxiciclina no absorbible.También considere la posibilidad de un lavado gástrico.
La diálisis no altera la vida media sérica de la doxiciclina, por lo que no sería beneficiosa en el tratamiento de casos de sobredosis.
05.0 PROPIEDADES FARMACOLÓGICAS
05.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antibacterianos de uso sistémico, tetraciclinas.
Código ATC: J01AA02.
Mecanismo de acción
La fisiopatología de las lesiones inflamatorias de la rosácea es, en parte, la manifestación de un proceso mediado por neutrófilos. Se ha demostrado que la doxiciclina inhibe la actividad de los neutrófilos y numerosas reacciones proinflamatorias, incluidas las asociadas con la fosfolipasa A2, el óxido nítrico endógeno y la interleucina 6. Se desconoce la importancia clínica de estos hallazgos.
Efectos farmacodinámicos
La concentración plasmática de doxiciclina después de la administración de Efracea está muy por debajo del nivel requerido para la inhibición de microorganismos comúnmente asociados con enfermedades bacterianas.
Estudios microbiológicos en vivo con una exposición similar al ingrediente activo durante 6 a 18 meses, no mostraron ningún efecto sobre la flora bacteriana dominante extraída de la cavidad bucal, la piel, el tracto intestinal y la vagina. Sin embargo, no se puede descartar que el uso prolongado de Efracea pueda conducir a la aparición de bacterias intestinales resistentes como Enterobacteriaceae y Enterococci, o al enriquecimiento de genes resistentes.
Eficacia clínica y seguridad
La oracea se evaluó en dos estudios piloto de 16 semanas, aleatorizados, doble ciego y controlados con placebo en 537 pacientes con rosácea (de 10 a 40 pápulas y pústulas y hasta dos nódulos). En ambos estudios, la reducción media en el recuento total de lesiones inflamatorias fue significativamente mayor en el grupo de Efracea que en el grupo de placebo:
Tabla 2 - Cambio medio desde el inicio hasta la semana 16 en el recuento total de lesiones inflamatorias:
un valor p para la diferencia entre tratamientos en función del cambio desde el valor inicial (ANOVA)
05.2 "Propiedades farmacocinéticas
Absorción
La doxiciclina se absorbe casi por completo después de la administración oral. Después de la administración oral de Efracea, las concentraciones plasmáticas máximas medias fueron 510 ng / ml después de una dosis única y 600 ng / ml en estado de equilibrio (día 7). Las concentraciones plasmáticas máximas se alcanzaron generalmente de 2 a 3 horas después de la administración. La administración concomitante de una comida rica en grasas y proteínas que incluía derivados de la leche redujo la biodisponibilidad (AUC) de la doxiciclina de Efracea en aproximadamente un 20% y redujo la concentración plasmática máxima en un 43%.
Distribución
La doxiciclina se une en más del 90% a las proteínas plasmáticas y tiene un volumen de distribución aparente de 50 l.
Biotransformación
No se han identificado las principales vías metabólicas de la doxiciclina, pero los inductores enzimáticos disminuyen su vida media.
Eliminación
La doxiciclina se excreta como principio activo inalterado en orina y heces. Después de 92 horas es posible recuperar entre el 40% y el 60% de la dosis administrada en la orina y aproximadamente el 30% en las heces. La semivida de eliminación terminal de la doxiciclina tras la administración de Efracea fue de aproximadamente 21 horas después de una dosis única y de aproximadamente 23 horas en estado de equilibrio.
Otras poblaciones especiales
La vida media de la doxiciclina no se altera significativamente en pacientes con función renal gravemente alterada. La doxiciclina no se elimina ampliamente durante la hemodiálisis.
No hay información sobre la farmacocinética de la doxiciclina en pacientes con insuficiencia hepática.
05.3 Datos preclínicos sobre seguridad
Las reacciones adversas observadas en estudios de dosis repetidas en animales incluyen hiperpigmentación de la glándula tiroides y degeneración tubular del riñón. Estos efectos se observaron a niveles de exposición entre 1,5 y 2 veces mayores que los observados en humanos a los que se les administró Efracea en las dosis propuestas, aunque se desconoce la relevancia clínica de estos hallazgos.
La doxiciclina no mostró actividad mutagénica ni evidencia convincente de actividad clastogénica. En un estudio de carcinogenicidad en ratas, se observaron aumentos en los tumores benignos de la glándula mamaria (fibroadenoma), útero (pólipo) y tiroides (adenoma de células C) en las hembras.
En la rata, dosis de 50 mg / kg / día de doxiciclina causaron una disminución en la velocidad de los espermatozoides en línea recta, pero no afectaron la fertilidad ni la morfología del esperma en machos o hembras. A esta dosis, la exposición sistémica a la que fueron sometidas las ratas probablemente sea aproximadamente 4 veces mayor que la observada en humanos que toman la dosis recomendada de Efracea. En dosis superiores a 50 mg / kg / día, la fertilidad y el rendimiento reproductivo en ratas, en el Por otro lado, se vieron afectados Un estudio sobre la toxicidad peri / posnatal en ratas reveló la ausencia de efectos significativos a dosis terapéuticamente relevantes. Se sabe que la doxiciclina atraviesa la placenta y los datos de la literatura indican que las tetraciclinas pueden tener efectos tóxicos en el feto en desarrollo.
06.0 INFORMACIÓN FARMACÉUTICA
06.1 Excipientes
Cáscara de la cápsula
Gelatina
Óxido de hierro negro
Óxido de hierro rojo
Óxido de hierro amarillo
Dióxido de titanio
Tintas de impresión
Goma laca
Propilenglicol
Óxido de hierro negro
Indigo Carmine - laca de aluminio
Allura Red AC - laca de aluminio (E129)
Brilliant Blue FCF - laca de aluminio
Amarillo D&C No. 10 - laca de aluminio
Contenido de la cápsula
Hipromelosa
Copolímero de ácido metacrílico-acrilato de etilo (1: 1)
Citrato de trietilo
Talco
Hipromelosa, dióxido de titanio, macrogol 400, óxido de hierro amarillo, óxido de hierro rojo, polisorbato 80
Bolas de azúcar (almidón de maíz, sacarosa)
06.2 Incompatibilidad
Irrelevante.
06.3 Período de validez
2 años.
06.4 Precauciones especiales de conservación
Almacenar en el paquete original para mantenerlo alejado de la luz.
06.5 Naturaleza del envase primario y contenido del envase.
Blister de aluminio / PVC / aclar
Embalaje:
56 cápsulas en 4 tiras de 14 cada una
28 cápsulas en 2 tiras de 14 cada una
14 cápsulas en 1 tira de 14
Es posible que no se comercialicen todos los tamaños de envases.
06.6 Instrucciones de uso y manipulación
Sin instrucciones especiales
07.0 TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GALDERMA ITALIA S.p.A.
Domicilio social: via dell "Annunciata 21 - 20121 MILÁN
08.0 NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Envase de 56 cápsulas en 4 tiras de 14 cada una, AIC n. 039130012
Envase de 28 cápsulas en 2 tiras de 14 cada una, AIC n. 039130024
Envase de 14 cápsulas en 1 tira, AIC n. 039130036
09.0 FECHA DE LA PRIMERA AUTORIZACIÓN O RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: febrero de 2010
10.0 FECHA DE REVISIÓN DEL TEXTO
10/2014