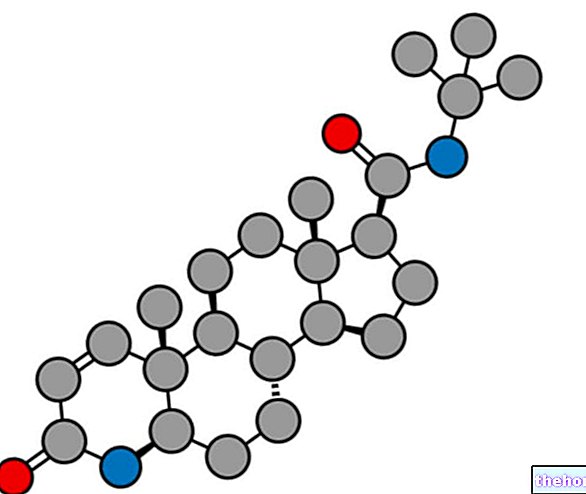
Ingredientes activos: Aripiprazol
ABILIFY 5 mg comprimidos
Los prospectos de Abilify están disponibles para los paquetes:- ABILIFY 5 mg comprimidos
- ABILIFY 10 mg comprimidos
- ABILIFY 15 mg comprimidos
- ABILIFY 30 mg comprimidos
- ABILIFY 10 mg comprimidos bucodispersables
- ABILIFY 15 mg comprimidos bucodispersables
- ABILIFY 30 mg comprimidos bucodispersables
- ABILIFY 1 mg / ml solución oral
- ABILIFY 7,5 mg / ml solución inyectable
¿Por qué se usa Abilify? ¿Para qué sirve?
ABILIFY contiene el principio activo aripiprazol y pertenece a un grupo de medicamentos denominados antipsicóticos. Se utiliza para tratar a adultos y adolescentes a partir de los 15 años que padecen una enfermedad caracterizada por síntomas como oír, ver o sentir cosas que no están presentes, desconfianza, creencias erróneas, habla y comportamiento incoherentes y aplanamiento de las emociones. Las personas con esta afección también pueden sentirse deprimidas, culpables, ansiosas o tensas.
ABILIFY se utiliza para tratar a adultos y adolescentes a partir de los 13 años que tienen una afección caracterizada por síntomas como sentirse "eufórico", tener demasiada energía, no necesitar dormir de lo habitual, hablar muy rápido. Con "vuelo de ideas" y a veces irritabilidad severa. También previene esta afección en adultos que han respondido al tratamiento con ABILIFY.
Contraindicaciones Cuándo no se debe usar Abilify
No tome ABILIFY
- Si es alérgico al aripiprazol oa cualquiera de los demás componentes de este medicamento.
Precauciones de uso Lo que necesita saber antes de tomar Abilify
Consulte a su médico antes de tomar ABILIFY si padece
- Niveles altos de azúcar en sangre (caracterizados por síntomas como sed excesiva, producción de grandes cantidades de orina, aumento del apetito y sensación de cansancio) o antecedentes familiares de diabetes.
- Convulsiones
- Movimientos musculares involuntarios e irregulares, especialmente de la cara.
- Trastornos cardiovasculares, antecedentes familiares de trastornos cardiovasculares, accidente cerebrovascular o ataque isquémico transitorio, presión arterial anormal
- Coágulos de sangre (coágulos de sangre en las venas) o antecedentes familiares de coágulos de sangre, ya que los antipsicóticos se han asociado con coágulos de sangre.
- Experiencia pasada de juego excesivo
Si nota que su peso está aumentando, si desarrolla movimientos inusuales, si tiene sueño que interfiere con sus actividades diarias normales, si tiene dificultad para tragar o si tiene síntomas alérgicos, por favor informe a su médico.
Si es un paciente anciano con demencia (pérdida de memoria y otras habilidades mentales), usted o su médico deben informar a su médico si ha tenido un accidente cerebrovascular o ataque isquémico transitorio (AIT) en el pasado).
Informe a su médico de inmediato si está pensando en hacerse daño. Se han notificado pensamientos y comportamientos suicidas durante el tratamiento con aripiprazol.
Informe a su médico de inmediato si tiene entumecimiento o rigidez muscular con fiebre alta, sudoración, estado mental alterado o latidos cardíacos muy rápidos o irregulares.
Niños y adolescentes
ABILIFY no debe utilizarse en niños y adolescentes menores de 13 años.
Consulte a su médico o farmacéutico antes de tomar ABILIFY.
Interacciones ¿Qué medicamentos o alimentos pueden cambiar el efecto de Abilify?
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Medicamentos que disminuyen la presión arterial: ABILIFY puede aumentar el efecto de los medicamentos utilizados para disminuir la presión arterial Informe a su médico si toma un medicamento para controlar la presión arterial.
Al tomar ABILIFY con otros medicamentos, puede ser necesario cambiar la dosis de ABILIFY. Es importante que informe a su médico, especialmente si está tomando los siguientes medicamentos:
- Medicamentos que corrigen el ritmo cardíaco.
- Antidepresivos o hierbas que se usan para tratar la depresión y la ansiedad.
- Agentes antifúngicos
- Algunos medicamentos para el tratamiento de la infección por VIH.
- Anticonvulsivos utilizados para tratar la epilepsia.
Medicamentos que aumentan el nivel de serotonina: triptanos, tramadol, triptófano, inhibidores selectivos de la recaptación de serotonina (ISRS) (como paroxetina y fluoxetina), tricíclicos (como clomipramina, amitriptilina), petidina, hierba de San Juan (hipericum) y venlafaxina. Estos medicamentos aumentan el riesgo de efectos secundarios; Si tiene algún síntoma inusual mientras toma alguno de estos medicamentos junto con ABILIFY, debe consultar a su médico.
ABILIFY con alimentos, bebidas y alcohol
ABILIFY se puede tomar independientemente de la comida. Se debe evitar el consumo de alcohol cuando se esté tratando con ABILIFY.
Advertencias Es importante saber que:
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Los siguientes síntomas pueden ocurrir en bebés recién nacidos, de madres que han usado ABILIFY en el último trimestre (últimos tres meses de su embarazo): temblores, rigidez y / o debilidad muscular, somnolencia, agitación, problemas respiratorios y dificultad para alimentarse. tiene alguno de estos síntomas, es posible que deba ponerse en contacto con su médico.
Informe a su médico de inmediato si está amamantando.
Si está tomando ABILIFY, no debe dar el pecho.
Conducción y uso de máquinas
No conduzca ni utilice herramientas o máquinas hasta que sepa cómo puede afectarle ABILIFY.
ABILIFY contiene lactosa
Si su médico le ha dicho que es intolerante a algunos azúcares, consulte con él antes de tomar este medicamento.
Dosis, método y momento de administración Cómo utilizar Abilify: Posología
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte a su médico o farmacéutico.
La dosis recomendada para adultos es de 15 mg una vez al día. Sin embargo, su médico puede recetarle una dosis mayor o menor hasta un máximo de 30 mg una vez al día.
Uso en niños y adolescentes.
ABILIFY puede iniciarse con una dosis más baja usando la solución oral (líquida). La dosis puede aumentarse gradualmente hasta la dosis recomendada para adolescentes de 10 mg una vez al día. Sin embargo, su médico puede recetarle una dosis mayor o menor hasta un máximo de 30 mg una vez al día.
Si estima que el efecto de ABILIFY es demasiado fuerte o demasiado débil, comuníqueselo a su médico o farmacéutico.
Intente tomar su tableta de ABILIFY a la misma hora todos los días. No importa si lo toma con comida o no, tome siempre la tableta con agua y tráguela entera.
Incluso si se siente bien, no cambie ni suspenda su dosis diaria de ABILIFY sin antes consultar con su médico.
Sobredosis Qué hacer si ha tomado una sobredosis de Abilify
Si toma más ABILIFY del que debiera
Si se da cuenta de que ha tomado más comprimidos de ABILIFY de los que le ha recomendado su médico (o si otra persona ha tomado algunos de sus comprimidos de ABILIFY), póngase en contacto con su médico inmediatamente. Si no puede comunicarse con el médico, vaya al hospital más cercano y llévese el paquete.
Si olvidó tomar ABILIFY
Si olvida una dosis, tómela tan pronto como se acuerde, pero no tome dos el mismo día.
Si tiene más preguntas sobre el uso de este medicamento, consulte a su médico o farmacéutico.
Efectos secundarios ¿Cuáles son los efectos secundarios de Abilify?
Como todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas): espasmos o espasmos incontrolables, dolor de cabeza, cansancio, náuseas, vómitos, sensación de malestar en el estómago, estreñimiento, aumento de la producción de saliva, mareos, dificultad para dormir, inquietud, sensación de ansiedad, sueño, agitación y visión borrosa.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas): algunas personas pueden sentirse mareadas, especialmente al levantarse de una posición acostada o sentada, o un ritmo cardíaco acelerado o visión doble. Algunas personas pueden sentirse deprimidas. Algunas personas pueden experimentar una "alteración o aumento" del interés sexual. Se han notificado los siguientes efectos adversos desde el inicio de la comercialización de ABILIFY, pero se desconoce la frecuencia con la que se produjeron (no puede estimarse a partir de los datos disponibles):
Cambios en los niveles de algunas células sanguíneas. latido cardíaco inusual, muerte súbita inexplicable, ataque cardíaco; reacción alérgica (por ejemplo, hinchazón en la boca, lengua, cara y garganta, picor, erupción cutánea); nivel alto de azúcar en sangre, aparición o empeoramiento de diabetes, cetoacidosis (cetonas en sangre y orina) o coma, bajo sodio en sangre; aumento de peso, pérdida de peso, anorexia; nerviosismo, agitación, ansiedad ludopatía excesiva; pensamientos de suicidio, intento de suicidio y suicidio; trastornos del habla, convulsiones, síndrome serotoninérgico (una reacción que puede causar sensación de gran felicidad, somnolencia, torpeza, inquietud, sensación de estar borracho, fiebre, sudoración o rigidez muscular), combinación de fiebre, rigidez muscular, respiración más rápida, sudoración, disminución conciencia y cambios repentinos en la presión arterial y el ritmo cardíaco; desmayo; Alta presión sanguínea; coágulos de sangre (coágulos de sangre en las venas), especialmente en las piernas (los síntomas incluyen hinchazón, dolor y enrojecimiento de la pierna), que pueden viajar a través de los vasos sanguíneos hasta los pulmones y causar dolor en el pecho y dificultad para respirar (si nota alguno de estos síntomas) , consulte a su médico inmediatamente); espasmo de los músculos alrededor de las cuerdas vocales, inhalación accidental de alimentos con riesgo de neumonía, dificultad para tragar; inflamación del páncreas; insuficiencia hepática, inflamación del hígado, coloración amarillenta de la piel y el blanco de los ojos, casos de pruebas de función hepática anormales; malestar abdominal y malestar estomacal, diarrea; erupción cutánea y sensibilidad a la luz, caída inusual del cabello o cabello quebradizo, sudoración excesiva; rigidez o calambres, dolor muscular, debilidad; pérdida involuntaria de orina, dificultad para orinar; erección prolongada y / o dolorosa; dificultad para controlar la temperatura corporal central o condiciones de calor excesivo, dolor de pecho, hinchazón de manos, tobillos o pies.
Se han reportado más casos fatales en pacientes ancianos con demencia cuando toman aripiprazol. Además, se han reportado accidentes cerebrovasculares o "mini" accidentes cerebrovasculares.
Efectos secundarios adicionales en niños y adolescentes
Los adolescentes a partir de los 13 años han experimentado efectos secundarios similares en frecuencia y tipo a los de los adultos, excepto somnolencia, espasmos musculares incontrolables o movimientos espasmódicos, inquietud y cansancio que eran muy frecuentes (más de 1 paciente de cada 10) y dolor en la parte superior del abdomen, boca seca, aumento de la frecuencia cardíaca, aumento de peso, aumento del apetito, espasmos musculares, movimientos incontrolados de las extremidades y mareos, especialmente al levantarse de una posición acostada o sentada, que eran frecuentes (más de 1 de cada 100 pacientes).
Notificación de efectos secundarios
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluidos los posibles efectos adversos que no aparecen en este prospecto. También puede informar los efectos secundarios directamente a través del sistema nacional de notificación. Al informar los efectos secundarios, puede ayudar a proporcionar más información sobre la seguridad de este medicamento.
Caducidad y retención
Mantenga este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el blister y la caja.
La fecha de vencimiento se refiere al último día de ese mes.
Almacene en el paquete original para proteger el medicamento de la humedad.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita, ya que esto ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
Qué contiene ABILIFY
- El ingrediente activo es aripiprazol. Cada comprimido contiene 5 mg de aripiprazol.
- Los demás componentes son lactosa monohidrato, almidón de maíz, celulosa microcristalina, hidroxipropilcelulosa, estearato de magnesio, laca de aluminio índigo carmín (E132).
Descripción del aspecto de ABILIFY y contenido del envase
Los comprimidos de ABILIFY 5 mg son rectangulares y están grabados en azul con "A-007" y "5" en una cara.
Están disponibles en blísters unidosis perforados en cajas que contienen 14, 28, 49, 56 o 98 comprimidos.
Es posible que no se comercialicen todos los tamaños de envases.
Prospecto fuente: AIFA (Agencia Italiana de Medicamentos). Contenido publicado en enero de 2016. Es posible que la información presente no esté actualizada.
Para tener acceso a la versión más actualizada, es recomendable acceder al sitio web de la AIFA (Agencia Italiana de Medicamentos). Descargo de responsabilidad e información útil.
01.0 NOMBRE DEL MEDICAMENTO
COMPRIMIDOS ABILIFY 5 MG
02.0 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido contiene 5 mg de aripiprazol.
Excipiente con efectos conocidos: 67 mg de lactosa por comprimido.
Para consultar la lista completa de excipientes, ver sección 6.1.
03.0 FORMA FARMACÉUTICA
Tableta.
Rectangular y repujado en azul con "A-007" y "5" en una cara.
04.0 INFORMACIÓN CLÍNICA
04.1 Indicaciones terapéuticas
ABILIFY está indicado para el tratamiento de la esquizofrenia en adultos y adolescentes a partir de los 15 años.
ABILIFY está indicado para el tratamiento de episodios maníacos de moderados a graves en el trastorno bipolar I y para la prevención de un nuevo episodio maníaco en adultos que han tenido episodios predominantemente maníacos que han respondido al tratamiento con aripiprazol (ver sección 5.1).
ABILIFY está indicado para el tratamiento, hasta 12 semanas, de episodios maníacos de moderados a graves en el trastorno bipolar I en adolescentes a partir de los 13 años (ver sección 5.1).
04.2 Posología y forma de administración
Dosis
Adultos
Esquizofrenia: La dosis inicial recomendada de ABILIFY es de 10 o 15 mg / día con una dosis de mantenimiento de 15 mg / día administrada una vez al día, independientemente de las comidas.
ABILIFY es eficaz en dosis de entre 10 y 30 mg / día. No se ha demostrado una mayor eficacia a dosis superiores a una dosis diaria de 15 mg, aunque algunos pacientes pueden beneficiarse de una dosis mayor. La dosis máxima diaria no debe exceder los 30 mg.
Episodios maníacos en el trastorno bipolar I: la dosis inicial recomendada de ABILIFY es de 15 mg administrados una vez al día con o sin comidas, como monoterapia o en combinación (ver sección 5.1). Algunos pacientes pueden beneficiarse de una dosis más alta. La dosis máxima diaria no debe exceder los 30 mg.
Prevención de recaídas de episodios maníacos en el trastorno bipolar I: Para la prevención de recaídas de episodios maníacos en pacientes que han sido tratados con aripiprazol solo o en terapia combinada, continúe el tratamiento con la misma dosis.Los ajustes diarios de la dosis, incluida la reducción de la dosis, se deben considerar en función del estado clínico del paciente.
Población pediátrica
Esquizofrenia en adolescentes a partir de los 15 años.: La dosis recomendada de ABILIFY es de 10 mg / día administrados una vez al día con o sin comidas. El tratamiento debe iniciarse con 2 mg (usando ABILIFY solución oral 1 mg / ml) durante 2 días, titulado a 5 mg durante 2 días más, para alcanzar la dosis diaria recomendada de 10 mg. Cuando sea apropiado, los aumentos de dosis posteriores deben administrarse en incrementos de 5 mg sin exceder la dosis diaria máxima de 30 mg (ver sección 5.1).
ABILIFY es eficaz en dosis de 10 a 30 mg / día. No se ha demostrado una mayor eficacia con dosis superiores a una dosis diaria de 10 mg, aunque los pacientes individuales pueden beneficiarse de una dosis más alta.
No se recomienda el uso de ABILIFY en pacientes con esquizofrenia menores de 15 años debido a que los datos sobre seguridad y eficacia son insuficientes (ver secciones 4.8 y 5.1).
Episodios maníacos del trastorno bipolar I en adolescentes a partir de los 13 años: la dosis recomendada de ABILIFY es de 10 mg / día administrados una vez al día con o sin comidas. El tratamiento debe iniciarse con 2 mg (usando ABILIFY 1 mg / ml solución oral) durante 2 días, titulado a 5 mg durante 2 días más, para alcanzar la dosis diaria recomendada de 10 mg.
La duración del tratamiento debe ser la mínima necesaria para el control de los síntomas y no debe exceder las 12 semanas. Con dosis superiores a la dosis diaria de 10 mg, no se ha demostrado una mayor eficacia, y una dosis diaria de 30 mg se asocia con una incidencia sustancialmente más alta de efectos secundarios significativos, incluidos eventos relacionados con síntomas extrapiramidales, somnolencia, fatiga y aumento de peso (ver sección 4.8). Por tanto, las dosis superiores a 10 mg / día solo deben utilizarse en casos excepcionales y bajo un estrecho seguimiento clínico (ver secciones 4.4, 4.8 y 5.1).
Los pacientes más jóvenes tienen un mayor riesgo de informar eventos adversos asociados con aripiprazol. Por tanto, no se recomienda el uso de ABILIFY en pacientes menores de 13 años (ver secciones 4.8 y 5.1).
Irritabilidad asociada con el trastorno autista: Aún no se ha establecido la seguridad y eficacia de ABILIFY en niños y adolescentes menores de 18 años. Los datos actualmente disponibles se describen en la sección 5.1, pero no se puede hacer una recomendación posológica.
Tics asociados con el síndrome de Tourette: Aún no se ha establecido la seguridad y eficacia de ABILIFY en niños y adolescentes de 6 a 18 años Los datos actualmente disponibles se describen en la sección 5.1, pero no se puede hacer una recomendación posológica.
Pacientes con insuficiencia hepática
No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve a moderada. En pacientes con insuficiencia hepática grave, los datos disponibles son insuficientes para hacer recomendaciones. En tales pacientes, la dosificación debe manejarse con precaución. Sin embargo, la dosis máxima diaria de 30 mg debe utilizarse con precaución en pacientes con insuficiencia hepática grave (ver sección 5.2).
Pacientes con insuficiencia renal
No se requiere ajuste de dosis en pacientes con insuficiencia renal.
Personas mayores
No se ha establecido la eficacia de ABILIFY en el tratamiento de la esquizofrenia y el trastorno bipolar I en pacientes de 65 años o más. Dada la mayor sensibilidad de esta población,
cuando las condiciones clínicas lo permitan, se debe considerar una dosis inicial más baja (ver sección 4.4).
Sexo
No se requiere ajuste de dosis para pacientes mujeres en comparación con pacientes masculinos (ver sección 5.2).
Estado de fumador
De acuerdo con la vía metabólica de aripiprazol, no se requiere ajuste de dosis para fumadores (ver sección 4.5).
Ajustes de dosis debido a interacciones.
Cuando se coadministra aripiprazol con inhibidores potentes de CYP3A4 o CYP2D6, se debe reducir la dosis de aripiprazol. Cuando el inhibidor de CYP3A4 o CYP2D6 se elimina de la terapia de combinación, se debe aumentar la dosis de aripiprazol (ver sección 4.5).
Cuando se administra aripiprazol concomitantemente con un inductor potente de CYP3A4, se debe aumentar la dosis de aripiprazol. Cuando el inductor de CYP3A4 se retira de la terapia de combinación, la dosis de aripiprazol debe reducirse a la recomendada (ver sección 4.5).
Método de administración
Los comprimidos de ABILIFY son para uso oral.
04.3 Contraindicaciones
Hipersensibilidad al principio activo oa alguno de los excipientes incluidos en la sección 6.1.
04.4 Advertencias especiales y precauciones de uso apropiadas
Durante el tratamiento con antipsicóticos, la mejora de la situación clínica del paciente puede tardar de varios días a varias semanas. Los pacientes deben ser monitoreados de cerca durante todo el período.
Suicidio
El inicio de la conducta suicida es inherente a la enfermedad psicótica y los trastornos del estado de ánimo y, en algunos casos, se ha notificado poco después del inicio o el cambio a la terapia antipsicótica, incluido el tratamiento con aripiprazol (ver sección 4.8). Debe acompañarse de una supervisión más estrecha de los pacientes de alto riesgo. Terapia antipsicótica: Los resultados de un estudio epidemiológico sugirieron que no existe un mayor riesgo de suicidio con aripiprazol en comparación con otros antipsicóticos en pacientes adultos con esquizofrenia o trastorno bipolar. No hay datos pediátricos suficientes para evaluar este riesgo en pacientes más jóvenes (menores de 18 años), pero hay evidencia de que el riesgo de suicidio persiste más allá de las primeras 4 semanas de tratamiento con antipsicóticos atípicos, incluido "aripiprazol".
Alteraciones cardiovasculares
Aripiprazol debe usarse con precaución en pacientes con enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o cardiopatía isquémica, insuficiencia cardíaca o anomalías de la conducción), trastorno cerebrovascular, afecciones que puedan predisponer a la hipotensión (deshidratación, hipovolemia y tratamiento con medicamentos antihipertensivos) o hipertensión, incluso acelerada o maligna.
Se han notificado casos de tromboembolismo venoso (TEV) con el uso de medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos a menudo presentan factores de riesgo adquiridos de TEV, se debe identificar cualquier posible factor de riesgo de TEV antes y durante el tratamiento. Deben tomarse medidas preventivas.
Anomalías de conducción
En los ensayos clínicos con aripiprazol, la incidencia de prolongación del intervalo QT fue comparable a la del placebo. Al igual que con otros antipsicóticos, aripiprazol debe usarse con precaución en pacientes con antecedentes familiares de prolongación del intervalo QT.
Discinesia tardía
En ensayos clínicos que duraron un año o menos, ha habido informes poco frecuentes de discinesia relacionada con el tratamiento durante el tratamiento con aripiprazol. Si se presentan signos y síntomas de discinesia tardía en pacientes que reciben ABILIFY, se debe considerar la reducción de la dosis o la interrupción, que pueden empeorar con el tiempo o incluso pueden ocurrir después de la interrupción del tratamiento.
Otros síntomas extrapiramidales
En los ensayos clínicos pediátricos de aripiprazol se observó acatisia y parkinsonismo. Si aparecen signos y síntomas de otros síntomas extrapiramidales en un paciente que toma ABILIFY, se debe considerar una reducción de la dosis y una estrecha monitorización clínica.
Síndrome neuroléptico maligno (SNM)
El SNM es un complejo de síntomas potencialmente mortal asociado con los medicamentos antipsicóticos. En estudios clínicos, se han notificado casos raros de SNM durante el tratamiento con aripiprazol. Las manifestaciones clínicas del SNM son hiperpirexia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autonómica (pulso o presión arterial irregular, taquicardia, diaforesis o disritmia cardíaca). Los signos adicionales pueden incluir creatina fosfoquinasa elevada, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda. Sin embargo, se han reportado niveles elevados de creatinfosfoquinasa y rabdomiólisis, no necesariamente asociados con NMS. Si un paciente desarrolla signos y síntomas sugestivos de SNM, o tiene fiebre alta de origen desconocido sin más manifestaciones clínicas de SNM, se deben suspender todos los medicamentos antipsicóticos, incluido ABILIFY.
Convulsiones
Se han notificado casos poco frecuentes de convulsiones en ensayos clínicos durante el tratamiento con aripiprazol. Por lo tanto, aripiprazol debe usarse con precaución en pacientes con antecedentes de trastornos convulsivos o que presenten afecciones asociadas con convulsiones.
Pacientes de edad avanzada con psicosis relacionada con la demencia
Aumento de la mortalidad
En tres ensayos clínicos controlados con placebo de aripiprazol (n = 938; edad media: 82,4 años; rango: 56-99 años) en pacientes ancianos con psicosis asociada con la enfermedad de Alzheimer, los pacientes tratados con aripiprazol informaron un mayor riesgo de muerte en comparación con los tomando placebo. La tasa de mortalidad en los pacientes tratados con aripiprazol fue del 3,5% en comparación con el 1,7% en el grupo de placebo. Aunque las causas de muerte fueron variadas, la mayoría de ellas fueron cardiovasculares (p. Ej., Infarto de miocardio, muerte súbita) o infecciosas (p. Ej., Neumonía). ).
Reacciones adversas cerebrovasculares
En los mismos estudios se informaron reacciones adversas cerebrovasculares (p. Ej., Ictus, accidente isquémico transitorio), incluidos casos con desenlace mortal (edad media: 84 años; rango: 78-88 años). En general, en estos estudios, el 1,3% de los pacientes tratados con aripiprazol notificaron reacciones adversas cerebrovasculares en comparación con el 0,6% de los pacientes tratados con placebo. Esta diferencia no fue estadísticamente significativa. Sin embargo, en uno de estos estudios, una dosis fija, hubo una dosis significativa. -relación de respuesta a reacciones adversas cerebrovasculares en pacientes tratados con aripiprazol.
ABILIFY no está aprobado para el tratamiento de la psicosis relacionada con la demencia.
Hiperglucemia y diabetes mellitus.
Se ha notificado hiperglucemia, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con medicamentos antipsicóticos atípicos, incluido ABILIFY. Los factores de riesgo que pueden predisponer a los pacientes a complicaciones graves incluyen la obesidad y los antecedentes familiares de diabetes. En los ensayos clínicos con aripiprazol, no se notificaron diferencias significativas en la tasa de incidencia de reacciones adversas relacionadas con la hiperglucemia (incluida la diabetes) o en la aparición de valores anormales de glucosa en sangre en comparación con placebo. No se dispone de estimaciones precisas del riesgo para las reacciones adversas relacionadas a la hiperglucemia en pacientes tratados con ABILIFY y otros medicamentos antipsicóticos atípicos para permitir una comparación directa.Se debe vigilar a los pacientes tratados con cualquier fármaco antipsicótico, incluido ABILIFY, para detectar signos y síntomas de hiperglucemia (como polidipsia, poliuria, polifagia y debilidad) y se debe controlar regularmente a los pacientes con diabetes mellitus o con factores de riesgo de diabetes mellitus. control.
Hipersensibilidad
Al igual que con otros medicamentos, pueden producirse reacciones de hipersensibilidad, caracterizadas por síntomas alérgicos, con aripiprazol (ver sección 4.8).
Aumento de peso
El aumento de peso, debido a comorbilidades, el uso de antipsicóticos que se sabe que causan aumento de peso, estilo de vida mal controlado, se observa comúnmente en pacientes con manía esquizofrénica y bipolar y puede conducir a complicaciones graves. Después de la comercialización, se ha informado aumento de peso en pacientes tratados con ABILIFY. Cuando se detectó, generalmente eran pacientes con factores de riesgo significativos como antecedentes de diabetes, trastorno tiroideo o adenoma hipofisario. En estudios clínicos, aripiprazol no demostró causar aumento de peso clínicamente relevante en adultos (ver sección 5.1). En estudios clínicos en pacientes adolescentes con manía bipolar, se ha demostrado que aripiprazol se asocia con aumento de peso después de 4 semanas de tratamiento, por lo que se debe controlar el aumento de peso en pacientes adolescentes con manía bipolar. Si el aumento de peso es clínicamente significativo, se debe considerar una reducción de la dosis (ver sección 4.8).
Disfagia
Los trastornos de la motilidad esofágica y la aspiración se han asociado con el tratamiento con antipsicóticos, incluido ABILIFY. El aripiprazol y otros principios activos antipsicóticos deben usarse con precaución en pacientes con riesgo de neumonía. ab ingestis.
Juego patológico
Se han notificado informes posteriores a la comercialización de ludopatía en pacientes a los que se les recetó ABILIFY, independientemente de si estos pacientes tenían antecedentes de ludopatía. Los pacientes con antecedentes de ludopatía patológica pueden tener un mayor riesgo y deben ser controlados de cerca (ver sección 4.8).
Lactosa
Los comprimidos de ABILIFY contienen lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
Pacientes con trastorno por déficit de atención con comorbilidades del trastorno por hiperactividad (TDAH)
A pesar de la alta frecuencia de comorbilidades del trastorno bipolar tipo I y el TDAH, se dispone de datos de seguridad muy limitados sobre el uso concomitante de ABILIFY y estimulantes; por lo tanto, se debe extremar la precaución cuando se administren estos medicamentos de forma concomitante.
04.5 Interacciones con otros medicamentos y otras formas de interacción
Debido a su antagonismo del receptor α1-adrenérgico, el aripiprazol tiene el potencial de mejorar el efecto de algunos antihipertensivos.
Dado el efecto principal de aripiprazol sobre el sistema nervioso central, se debe tener precaución cuando se tome en combinación con alcohol u otros medicamentos de acción central con reacciones adversas superpuestas como la sedación (ver sección 4.8).
Se debe tener precaución cuando se administre aripiprazol concomitantemente con medicamentos que se sabe que causan prolongación del intervalo QT o desequilibrio electrolítico.
Posibilidad de que otros medicamentos afecten a ABILIFY
El antagonista H2 famotidina, un bloqueador del ácido gástrico, reduce la velocidad de absorción del aripiprazol, pero no se cree que este efecto sea clínicamente relevante.
El aripiprazol se metaboliza a través de varias vías que involucran a las enzimas CYP2D6 y CYP3A4, pero no a las enzimas CYP1A, por lo que no es necesario ajustar la dosis para los fumadores.
Quinidina y otros inhibidores de CYP2D6
En un estudio clínico en sujetos sanos, un inhibidor potente de CYP2D6 (quinidina) aumentó el AUC de aripiprazol en un 107%, mientras que la Cmáx se mantuvo sin cambios. El AUC y la Cmáx del dehidroaripiprazol, el metabolito activo, se redujeron en un 32% y un 47%, respectivamente, dosis prescritas. Se espera que otros inhibidores potentes de CYP2D6, como fluoxetina y paroxetina, tengan efectos similares y se deben aplicar reducciones de dosis similares.
Ketoconazol y otros inhibidores de CYP3A4
En un estudio clínico con sujetos sanos, un inhibidor potente del CYP3A4 (ketoconazol) aumentó el AUC y la Cmáx en un 63% y un 37%, respectivamente. El AUC y la Cmáx de dehidroaripiprazol aumentaron en un 77% y la Cmáx, respectivamente, en un 43%. En los metabolizadores lentos del CYP2D6, el uso concomitante de inhibidores potentes del CYP3A4 puede resultar en concentraciones plasmáticas de aripiprazol más altas que las de los metabolizadores rápidos del CYP2D6. Cuando se considere la administración concomitante de ketoconazol u otros inhibidores potentes del CYP3A4 con ABILIFY, los beneficios potenciales para el paciente deben superar los posibles En caso de administración concomitante de ketoconazol y ABILIFY, la dosis de ABILIFY debe reducirse aproximadamente a la mitad de la dosis prescrita. Se espera que otros inhibidores potentes del CYP3A4, como el itraconazol y los inhibidores de la proteasa del VIH, tengan efectos similares y, por lo tanto, deben aplicarse reducciones de dosis similares.
Tras la interrupción de la administración de inhibidores de CYP2D6 y CYP3A4, la dosis de ABILIFY debe aumentarse al nivel anterior al inicio de la terapia de combinación.
Cuando se utilizan inhibidores débiles de CYP3A4 (p. Ej., Diltiazem o escitalopram) o CYP2D6 concomitantemente con ABILIFY, pueden producirse aumentos moderados de las concentraciones de aripiprazol.
Carbamazepina y otros inductores de CYP3A4
Tras la administración concomitante de carbamazepina, un potente inductor de CYP3A4, las medias geométricas de la Cmáx y el AUC de aripiprazol fueron un 68% y un 73% más bajas, respectivamente, en comparación con cuando se administró aripiprazol (30 mg) solo. Las medias geométricas de la Cmáx y el AUC después de la administración concomitante de carbamazepina fueron un 69% y un 71% más bajas, respectivamente, que las observadas después del tratamiento con aripiprazol solo.
La dosis de ABILIFY debe duplicarse en caso de administración concomitante de ABILIFY y carbamazepina. Otros inductores potentes de CYP3A4 (como rifampicina, rifabutina, fenitoína, fenobarbital, primidona, efavirenz, nevirapina y Hypericum perforatum) tienen los mismos efectos, por lo tanto, se deben realizar aumentos de dosis similares. Tras la interrupción del uso de inductores potentes de CYP3A4, la dosis de ABILIFY debe reducirse a la dosis recomendada.
Valproato y litio
No hubo cambios clínicamente significativos en las concentraciones de aripiprazol cuando se coadministraron litio y valproato con aripiprazol.
Síndrome serotoninérgico
Se han notificado casos de síndrome serotoninérgico en pacientes que reciben aripiprazol, y los posibles signos y síntomas de esta afección pueden ocurrir especialmente en casos de uso concomitante con otros medicamentos serotoninérgicos, como ISRS / IRSN, o con otros medicamentos que se sabe que aumentan las concentraciones. aripiprazol (ver sección 4.8).
Posibilidad de que ABILIFY afecte a otros medicamentos
En estudios clínicos, las dosis de aripiprazol de 10-30 mg / día no mostraron efectos significativos sobre el metabolismo de los sustratos de CYP2D6 (relación dextrometorfano / 3-metoximorfina), CYP2C9 (warfarina), CYP2C19 (omeprazol) y CYP3A4 (dextrometorfano). . Además, no se ha demostrado que aripiprazol y dehidroaripiprazol alteren potencialmente la actividad metabólica. in vitro mediada por CYP1A2. Por lo tanto, se considera poco probable que aripiprazol cause interacciones medicamentosas clínicamente relevantes mediadas por estas enzimas.
Cuando se coadministró aripiprazol con valproato, litio o lamotrigina, no hubo cambios clínicamente significativos en las concentraciones de esta última.
04.6 Embarazo y lactancia
El embarazo
No existen estudios específicos y adecuadamente controlados con aripiprazol en mujeres embarazadas. Se han informado anomalías congénitas; sin embargo, no se puede establecer una relación causal con aripiprazol. Los estudios en animales no pueden excluir una posible toxicidad para el desarrollo (ver sección 5.3). Se debe advertir a las pacientes que informen a su médico si están embarazadas o tienen la intención de quedar embarazadas durante el tratamiento con aripiprazol. Dada la información insuficiente sobre la seguridad en humanos y las cuestiones planteadas por los estudios de reproducción en animales, este medicamento no debe utilizarse durante el embarazo a menos que el beneficio esperado justifique claramente el riesgo potencial para el feto.
Los bebés expuestos a antipsicóticos (incluido aripiprazol) durante el tercer trimestre del embarazo tienen riesgo de reacciones adversas que incluyen síntomas extrapiramidales y / o de abstinencia que pueden variar en gravedad y duración después del parto. Se han notificado casos de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad para respirar o alteraciones de la alimentación, por lo que se debe vigilar estrechamente a los recién nacidos.
Hora de la comida
El aripiprazol se excreta en la leche materna. Se debe advertir a las pacientes que no amamanten si están tomando aripiprazol.
04.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Al igual que con otros antipsicóticos, se debe advertir a los pacientes sobre el uso de maquinaria peligrosa, incluidos los vehículos de motor, hasta que estén razonablemente seguros de que aripiprazol no los afecta negativamente. Algunos pacientes pediátricos con trastorno bipolar I tienen una mayor incidencia de somnolencia y fatiga (ver sección 4.8).
04.8 Efectos indeseables
Resumen del perfil de seguridad
Las reacciones adversas más comunes notificadas en los ensayos clínicos controlados con placebo son acatisia y náuseas, cada una de las cuales ocurre en más del 3% de los pacientes tratados con aripiprazol oral.
Tabla de reacciones adversas
Las siguientes reacciones adversas ocurrieron con más frecuencia (≥ 1/100) que el placebo, o se identificaron como reacciones adversas con posible relevancia médica (*).
La frecuencia enumerada a continuación se describe utilizando la siguiente convención: común (≥ 1/100 a
Descripción de reacciones adversas particulares
Síntomas extrapiramidales
Esquizofrenia - en un estudio controlado a largo plazo de 52 semanas, los pacientes tratados con aripiprazol tuvieron una "incidencia global (25,8%) menor de síntomas extrapiramidales, incluidos parkinsonismo, acatisia, distonía y discinesia que los tratados con haloperidol (57,3%). En En un estudio controlado con placebo a largo plazo de 26 semanas, la incidencia de síntomas extrapiramidales fue del 19% para los pacientes tratados con aripiprazol y del 13,1% para los pacientes tratados con placebo. En otro estudio controlado a largo plazo de 26 semanas, la incidencia de síntomas extrapiramidales fue del 14,8% para los pacientes tratados con aripiprazol y del 15,1% para los pacientes tratados con olanzapina. Episodios maníacos en el trastorno bipolar I - en un estudio controlado de 12 semanas, la incidencia de síntomas extrapiramidales fue del 23,5% en pacientes tratados con aripiprazol y del 53,3% en pacientes tratados con haloperidol. En otro estudio de 12 semanas, la incidencia de síntomas extrapiramidales fue del 26,6% en pacientes tratados con aripiprazol y 17,6% en los tratados con litio. En un estudio a largo plazo controlado con placebo, en la fase de mantenimiento de 26 semanas, la incidencia de síntomas extrapiramidales fue del 18,2% en los pacientes tratados con aripiprazol y del 15,7% en los pacientes tratados con placebo.
Acatisia
En estudios controlados con placebo, la incidencia de acatisia en pacientes con trastorno bipolar fue del 12,1% con aripiprazol y del 3,2% con placebo. En pacientes con esquizofrenia, la incidencia de acatisia fue del 6,2% con aripiprazol y del 3,0% con placebo.
Distonía
Efecto de clase: Los síntomas de distonía, contracciones anormales prolongadas de grupos de músculos, pueden ocurrir en individuos sensibles durante los primeros días de tratamiento. Los síntomas distónicos incluyen: espasmo de los músculos del cuello, a veces progresivo a estrechamiento de la garganta, dificultad para tragar, dificultad para respirar y / o protrusión de la lengua. Si bien estos síntomas pueden ocurrir en dosis bajas, pueden ocurrir con más frecuencia y con mayor gravedad con fármacos antipsicóticos de primera generación de alta potencia y dosis más altas. Se observó un alto riesgo de distonía aguda en pacientes masculinos y grupos de pacientes más jóvenes.
La comparación entre aripiprazol y placebo en la proporción de pacientes que exhibieron cambios potencialmente significativos clínicamente en los parámetros rutinarios de laboratorio y de lípidos (ver sección 5.1) no mostró diferencias de importancia médica. Se observaron elevaciones de la creatinfosfoquinasa (CPK), generalmente transitorias y asintomáticas, en el 3,5% de los pacientes tratados con aripiprazol en comparación con el 2,0% de los pacientes que recibieron placebo.
Otros resultados
Las reacciones adversas asociadas con el tratamiento antipsicótico y también notificadas durante el tratamiento con aripiprazol incluyen síndrome neuroléptico maligno, discinesia tardía, convulsiones, reacciones adversas cerebrovasculares y aumento de la mortalidad en pacientes de edad avanzada con demencia, hiperglucemia y diabetes mellitus (ver sección 4.4).
Población pediátrica
Esquizofrenia en adolescentes a partir de los 15 años.
En un ensayo clínico a corto plazo controlado con placebo de 302 adolescentes (13-17 años) con esquizofrenia, la frecuencia y el tipo de reacciones adversas fueron similares a las de los adultos, excepto por las siguientes reacciones, notificadas con mayor frecuencia en adolescentes tratados con aripiprazol. que en adultos tratados con aripiprazol (y con más frecuencia que con placebo):
Se notificaron somnolencia / sedación y trastornos extrapiramidales con mucha frecuencia (≥ 1/10), y con frecuencia se notificó sequedad de boca, aumento del apetito e hipotensión ortostática (≥ 1/100, la prolactina sérica fue en mujeres (
Episodios maníacos del trastorno bipolar I en adolescentes a partir de los 13 años
La frecuencia y el tipo de reacciones adversas en adolescentes con trastorno bipolar I fueron similares a las de los adultos, excepto por las siguientes reacciones: somnolencia (23,0%), trastornos extrapiramidales (18,4%), acatisia (16,0%) y fatiga (11,8%). %) fueron muy frecuentes (≥ 1/10); Fueron frecuentes dolor abdominal superior, aumento de la frecuencia cardíaca, aumento de peso, aumento del apetito, espasmos musculares y discinesia (≥ 1/100,
Las siguientes reacciones adversas tienen una posible relación con la dosis; trastornos extrapiramidales (la incidencia fue del 9,1% con 10 mg, 28,8% con 30 mg, 1,7% con placebo); y acatisia (las incidencias fueron 12,1% con 10 mg, 20,3% con 30 mg, 1,7% con placebo).
Los cambios medios de peso corporal en adolescentes con trastorno bipolar I a las 12 y 30 semanas fueron de 2,4 kg y 5,8 kg con aripiprazol y de 0,2 kg y 2,3 kg con placebo, respectivamente.
En la población pediátrica, la somnolencia y la fatiga se observaron con más frecuencia en pacientes con trastorno bipolar que en aquellos con esquizofrenia.
En la población pediátrica bipolar (10-17 años) con exposición de hasta 30 semanas, la incidencia de niveles bajos de prolactina sérica en mujeres (
Experiencia poscomercialización
Se han notificado las siguientes reacciones adversas durante la vigilancia poscomercialización. La frecuencia de estas reacciones se considera desconocida (no puede estimarse a partir de los datos disponibles).
Notificación de sospechas de reacciones adversas
La notificación de sospechas de reacciones adversas que se produzcan después de la autorización del medicamento es importante, ya que permite un seguimiento continuo de la relación beneficio / riesgo del medicamento. Se invita a los profesionales sanitarios a notificar cualquier sospecha de reacciones adversas a través del sistema nacional de notificación. En "Anexo V .
04.9 Sobredosis
Signos y síntomas
En estudios clínicos y en la experiencia postcomercialización, se ha identificado una sobredosis aguda accidental o intencionada de aripiprazol solo en pacientes adultos con dosis notificadas superiores a 1260 mg sin desenlace fatal. Los signos y síntomas potencialmente importantes desde un punto de vista observado han incluido letargo, aumento de presión arterial, somnolencia, taquicardia, náuseas, vómitos y diarrea.Además, se han notificado casos de sobredosis accidental con aripiprazol solo (con dosis de hasta 195 mg) en niños sin desenlace mortal. Los signos y síntomas potencialmente graves notificados clínicamente han incluido somnolencia. , pérdida transitoria del conocimiento y síntomas extrapiramidales.
Tratamiento de sobredosis
El tratamiento de la sobredosis debe centrarse en la atención de apoyo, el mantenimiento de un aclaramiento adecuado de las vías respiratorias, la oxigenación y ventilación adecuadas y el control de los síntomas. Se debe considerar la posibilidad de participación de múltiples fármacos. Luego, se debe iniciar. Después de una sobredosis de aripiprazol confirmada o sospechada, se requiere un control médico continuo hasta que el paciente se recupere.
El carbón activado (50 g), administrado una hora después de aripiprazol, disminuyó la Cmax en aproximadamente un 41% y el AUC en aproximadamente un 51%, lo que sugiere que el carbón vegetal puede ser eficaz para el tratamiento de la sobredosis.
Hemodiálisis
Aunque no se dispone de información sobre el efecto de la hemodiálisis en el tratamiento de la sobredosis de aripiprazol, es poco probable que sea útil en el tratamiento de la sobredosis debido a la alta unión de aripiprazol a proteínas plasmáticas.
05.0 PROPIEDADES FARMACOLÓGICAS
05.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: otros antipsicóticos.
Código ATC: N05AX12.
Mecanismo de acción
Se ha propuesto que la eficacia del aripiprazol en la esquizofrenia y el trastorno bipolar I está mediada por una combinación de una actividad agonista parcial sobre los receptores de dopamina D2 y serotoninérgicos 5HT1a y una acción antagonista sobre los receptores serotoninérgicos 5HT2a. y propiedades agonistas en modelos animales de hipoactividad dopaminérgica. In vitro, el aripiprazol muestra una alta afinidad de unión por los receptores dopaminérgicos D2 y D3, por los receptores serotoninérgicos 5HT1a y 5HT2a y una afinidad moderada por el dopaminérgico D4, por los serotoninérgicos 5HT2c y 5HT7, los alfa1-histamínicos H1 y los alfa1-histamínicos. El aripiprazol también mostró una afinidad de unión moderada por el sitio de recaptación de serotonina y ninguna afinidad apreciable por los receptores muscarínicos. La interacción con subtipos de receptores distintos de los subtipos dopaminérgico y serotoninérgico puede explicar algunos de los otros efectos clínicos del aripiprazol.Las dosis de aripiprazol que varían de 0,5 a 30 mg administradas una vez al día a sujetos sanos durante 2 semanas dieron como resultado una reducción dependiente de la dosis en la unión del 11C-raclopide, un ligando del receptor D2 / D3, al caudado y al putamen, detectado por emisión de positrones. tomografía.
Eficacia clínica y seguridad
Esquizofrenia
En tres ensayos clínicos controlados con placebo a corto plazo (4 a 6 semanas) en los que participaron 1.228 pacientes esquizofrénicos adultos con síntomas positivos o negativos, el aripiprazol se asoció con mejoras mayores y estadísticamente significativas en los síntomas psicóticos que el placebo.
ABILIFY es eficaz para mantener la mejoría clínica durante la terapia continua en pacientes adultos que han mostrado una respuesta al tratamiento inicial. En un estudio controlado con haloperidol, la proporción de pacientes que responden y mantienen una respuesta al tratamiento a las 52 semanas fue similar en ambos grupos (aripiprazol 77% y haloperidol 73%). La tasa total de finalización del estudio fue significativamente mayor para los pacientes que tomaban aripiprazol (43%) que para los que tomaban haloperidol (30%). Las puntuaciones actuales en las escalas de calificación utilizadas como criterios de valoración secundarios, incluida la PANSS y la escala de calificación de depresión de Montgomery-Asberg, mostraron resultados significativos mejora con respecto al haloperidol.
En un estudio controlado con placebo de 26 semanas en pacientes adultos con esquizofrenia crónica estabilizada, el grupo de aripiprazol tuvo una reducción significativamente mayor en la tasa de recaída, 34% en el grupo de aripiprazol y 57% en el grupo de placebo.
Aumento de peso - En los ensayos clínicos, no se demostró que el aripiprazol induzca un aumento de peso clínicamente relevante. los pacientes tuvieron un aumento de peso de al menos un 7% con respecto al valor inicial (es decir, un aumento de al menos 5,6 libras para un peso inicial medio de ≈ 80,5 kg) en los pacientes tratados con aripiprazol (n = 18, o el 13% de los pacientes evaluables) en comparación con los pacientes tratados con olanzapina (n = 45, o 33% de los pacientes evaluables).
Parámetros lipídicos - En un análisis conjunto de ensayos clínicos controlados con placebo en adultos, no se demostró que aripiprazol induzca cambios clínicamente relevantes en los niveles de colesterol total, triglicéridos, HDL y LDL.
• Colesterol total: la incidencia de cambios en los niveles desde lo normal (
• Triglicéridos en ayunas: la incidencia de cambios en los niveles desde lo normal (
• HDL: la incidencia de cambios en los niveles desde lo normal (
• LDL en ayunas: la incidencia de cambios en los niveles desde lo normal (
Episodios maníacos en el trastorno bipolar I
En dos estudios de monoterapia controlados con placebo de dosis flexible de 3 semanas en pacientes con trastorno bipolar I, episodios maníacos o mixtos, aripiprazol demostró una eficacia superior al placebo para reducir los síntomas maníacos después de 3 semanas. Estos estudios incluyeron pacientes con o sin síntomas psicóticos y con o sin ciclos rápidos.
En un estudio de monoterapia controlado con placebo de dosis fija de 3 semanas en pacientes con trastorno bipolar I con un episodio maníaco o mixto, el aripiprazol no demostró mayor eficacia que el placebo.
En dos estudios de monoterapia controlados con placebo o con activo de 12 semanas en pacientes con trastorno bipolar I, episodio maníaco o mixto, con o sin síntomas psicóticos, aripiprazol demostró una eficacia superior a placebo a las 3 semanas y mantenimiento de una eficacia comparable a la del litio o haloperidol a las 12 semanas Además, aripiprazol ha informado una proporción comparable de pacientes en remisión sintomática de manía a litio o haloperidol a las 12 semanas.
En un estudio de 6 semanas controlado con placebo en pacientes con trastorno bipolar I con episodio maníaco o mixto, con o sin síntomas psicóticos, que respondieron parcialmente al tratamiento con litio o valproato, como monoterapia durante 2 semanas a niveles séricos terapéuticos, la combinación con aripiprazol resultó en una eficacia superior al litio o al valproato solo para reducir los síntomas maníacos.
En un estudio controlado con placebo de 26 semanas seguido de una fase de extensión de 74 semanas, en pacientes maníacos que habían alcanzado la remisión con aripiprazol durante una fase de estabilización antes de la aleatorización, el aripiprazol demostró superioridad sobre el placebo para prevenir la recaída en la fase maníaca, pero no se ha demostrado que sea superior al placebo para prevenir la recaída en la depresión.
En un estudio controlado con placebo de 52 semanas en pacientes con trastorno bipolar I con episodio maníaco o mixto que lograron una remisión prolongada (puntuación total de Y-MRS y MADRS ≤ 12) con aripiprazol (de 10 mg / día a 30 mg / día) combinado con litio o valproato durante 12 semanas consecutivas, la combinación con aripiprazol fue superior al placebo con una disminución del riesgo del 46% (índice de riesgo 0,54) en la prevención de recaídas para cualquier episodio de "estado de ánimo y una disminución del riesgo del 65% (índice de riesgo 0,35) en la prevención de recaídas maníacas en comparación con la combinación con placebo, pero la combinación no fue superior al placebo en la prevención de recaídas depresivas. La combinación con aripiprazol fue superior al placebo en CGI-BP Disease Severity (Mania) (medida de resultado secundaria).
En este estudio, los investigadores asignaron a los pacientes a monoterapia abierta con litio o valproato para determinar las no respuestas parciales. Los pacientes se estabilizaron durante al menos 12 semanas consecutivas con la combinación de aripiprazol y el mismo estabilizador del estado de ánimo.
Los pacientes estabilizados fueron luego aleatorizados para continuar con el mismo estabilizador del estado de ánimo con aripiprazol doble ciego o placebo Se evaluaron cuatro subgrupos de estabilizadores del estado de ánimo en la fase aleatorizada: aripiprazol + litio; aripiprazol + valproato; placebo + litio; placebo + valproato.
Para el grupo de combinación, las tasas de recaída de Kaplan-Meier para cualquier episodio del estado de ánimo fueron del 16% con aripiprazol + litio y del 18% con aripiprazol + valproato en comparación con el 45% con placebo + litio y el 19% con placebo + valproato.
Población pediátrica
Esquizofrenia en adolescentes
En un estudio controlado con placebo de 6 semanas en el que participaron 302 pacientes esquizofrénicos adolescentes (13-17 años), que presentaban síntomas positivos o negativos, el aripiprazol se asoció con mejoras mayores y estadísticamente significativas en los síntomas psicóticos que el placebo.
En un subanálisis de pacientes adolescentes de 15 a 17 años, que representan el 74% de la población total inscrita, se observó el mantenimiento del efecto durante el estudio de extensión abierto de 26 semanas.
Episodios maníacos en niños y adolescentes con trastorno bipolar tipo I
El aripiprazol se estudió en un estudio controlado con placebo de 30 semanas en el que participaron 296 niños y adolescentes (10-17 años) que cumplían con los criterios del DSM-IV para el trastorno bipolar I con episodios maníacos o mixtos con o sin manifestaciones psicóticas y con un valor basal de Y- Puntuación de MRS ≥ 20. Entre los pacientes incluidos en el análisis de eficacia primario, 139 pacientes fueron diagnosticados con comorbilidad de TDAH.
El aripiprazol fue superior al placebo en el cambio de la puntuación total de Y-MRS desde el inicio en la semana 4 y la semana 12. En un análisis post-hoc, la mejoría versus placebo fue más pronunciada en pacientes con comorbilidades asociadas con TDAH que en pacientes con comorbilidades asociadas con TDAH. al grupo sin TDAH, en el que no hubo diferencia con el placebo. No se ha establecido la prevención de recaídas.
Tabla 1: Mejoría media desde el inicio en la puntuación YMRS para comorbilidad psiquiátrica
n = 51 en la semana 4
bn = 46 en la semana 4
Los eventos adversos más comunes que surgieron del tratamiento entre los pacientes que recibieron 30 mg fueron trastorno extrapiramidal (28,3%), somnolencia (27,3%), dolor de cabeza (23,2%) y náuseas (14,1%).). El aumento de peso medio durante el intervalo de tratamiento de 30 semanas fue de 2,9 kg en comparación con 0,98 kg en los pacientes tratados con placebo.
Irritabilidad asociada con el trastorno autista en pacientes pediátricos (ver sección 4.2)
El aripiprazol se ha estudiado en pacientes de 6 a 17 años en dos estudios de 8 semanas controlados con placebo [una dosis flexible (2-15 mg por día) y una dosis fija (5, 10 o 15 mg por día) mg por día)] y en un estudio abierto que duró 52 semanas. En estos estudios, la dosis inicial es de 2 mg por día, aumentada a 5 mg por día después de una semana y aumentada en 5 mg por día cada semana hasta alcanzar la dosis establecida. Más del 75% de los pacientes tenían menos de 13 años. El aripiprazol mostró una eficacia estadísticamente superior al placebo en la subescala de irritabilidad Lista de verificación de comportamiento aberrante. Sin embargo, no se ha establecido la relevancia clínica de estos hallazgos. El perfil de seguridad incluyó aumento de peso y cambios en los niveles de prolactina. La duración del estudio de seguridad a largo plazo se limitó a 52 semanas. En el grupo de estudios clínicos realizados, la incidencia de niveles bajos de prolactina sérica en mujeres (
El aripiprazol también se estudió en un estudio de mantenimiento a largo plazo controlado con placebo. Después de una estabilización de 13 a 26 semanas con aripiprazol (2 a 15 mg al día), los pacientes con una respuesta estable se mantuvieron con el tratamiento con aripiprazol o cambiaron a placebo durante 16 semanas más. Las tasas de recaída de Kaplan-Meier en la semana 16 fueron 35% para aripiprazol y 52% para placebo; la tasa de riesgo de recaída a las 16 semanas (aripiprazol / placebo) fue de 0,57 (diferencia no estadísticamente significativa). El aumento de peso medio después de la fase de estabilización (hasta 26 semanas) con aripiprazol fue de 3,2 kg, y se observó un aumento de peso medio adicional de 2,2 durante la segunda fase (16 semanas) del estudio. Kg para aripiprazol en comparación con 0,6 kg para placebo Los síntomas extrapiramidales se notificaron principalmente durante la fase de estabilización en el 17% de los pacientes, con temblor en el 6,5% de los pacientes.
Tics asociados con el síndrome de Tourette en pacientes pediátricos (ver sección 4.2)
La eficacia de aripiprazol se estudió en sujetos pediátricos con síndrome de Tourette (aripiprazol: n = 99, placebo: n = 44) en un estudio aleatorizado, doble ciego, controlado con placebo, de 8 semanas utilizando un diseño con dosis fija basada en el peso. grupos de tratamiento, para un rango de dosis de 5 mg / día a 20 mg / día con una dosis inicial de 2 mg. Los pacientes tenían entre 7 y 17 años de edad y tenían una puntuación media de 30 en la escala global de severidad de tics de Yale (YGTSS) Puntaje total de tic (TTS) al inicio. El aripiprazol demostró una mejora en el cambio de TTS en YGTSS entre el inicio y la semana 8 de 13,35 en el grupo de dosis baja (5 mg o 10 mg) y 16,94 en el grupo de dosis alta (10 mg o 20 mg)) en comparación con una mejora de 7.09 en el grupo placebo.
La eficacia de aripiprazol en sujetos pediátricos con síndrome de Tourette (aripiprazol: n = 32, placebo: n = 29) también se estudió en un rango de dosis flexible entre 2 mg / día y 20 mg / día con una dosis inicial única de 2 mg, en un estudio de 10 semanas, aleatorizado, doble ciego y controlado con placebo realizado en Corea del Sur. Los pacientes tenían entre 6 y 18 años y tenían una puntuación media de 29 en el TTS de YGTSS al inicio. El grupo de aripiprazol demostró una mejora de 14,97 en el cambio en YGTSS TTS entre el valor inicial y la semana 10 en comparación con una mejora de 9,62 en el grupo de placebo.
Teniendo en cuenta la magnitud del efecto del tratamiento en relación con el gran efecto placebo y los efectos poco claros sobre el funcionamiento psicosocial, no se ha establecido la relevancia clínica de los resultados de eficacia en estos dos estudios a corto plazo. No existen datos a largo plazo sobre la eficacia y seguridad de aripiprazol en este trastorno fluctuante.
La Agencia Europea de Medicamentos ha aplazado la obligación de presentar los resultados de los estudios con ABILIFY en uno o más subconjuntos de la población pediátrica para el tratamiento de la esquizofrenia y el trastorno afectivo bipolar (ver sección 4.2 para obtener información sobre uso pediátrico).
05.2 Propiedades farmacocinéticas
Absorción
El aripiprazol se absorbe bien y las concentraciones plasmáticas máximas se alcanzan en las 3-5 horas posteriores a la administración. El aripiprazol sufre un metabolismo presistémico mínimo. La biodisponibilidad oral absoluta de la formulación del comprimido es del 87%. Una comida rica en grasas no tiene ningún efecto sobre la farmacocinética de aripiprazol.
Distribución
El aripiprazol se distribuye ampliamente por todo el organismo con un volumen aparente de distribución de 4,9 l / kg, lo que indica una amplia distribución extravascular. A concentraciones terapéuticas, el aripiprazol y el deshidroaripiprazol se unen a las proteínas plasmáticas en un grado superior al 99%, principalmente a la albúmina.
Biotransformación
El aripiprazol se metaboliza ampliamente en el hígado, principalmente a través de tres vías de biotransformación: deshidrogenación, hidroxilación y N-desalquilación. Según los estudios in vitro, las enzimas CYP3A4 y CYP2D6 son responsables de la deshidrogenación e hidroxilación del aripiprazol, y la N-desalquilación es catalizada por CYP3A4. El aripiprazol es la molécula predominante en la circulación sistémica. En estado estacionario, el dehidroaripiprazol, el metabolito activo, representa aproximadamente el 40% del AUC de aripiprazol en plasma.
Eliminación
La semivida de eliminación media de aripiprazol es de aproximadamente 75 horas en los metabolizadores potentes del CYP2D6 y de aproximadamente 146 horas en los metabolizadores débiles del CYP2D6.
El aclaramiento corporal total de aripiprazol es de 0,7 ml / min / kg, principalmente a través del hígado.
Después de una dosis oral única de aripiprazol marcado con 14C, aproximadamente el 27% de la radiactividad administrada se recuperó en la orina y aproximadamente el 60% en las heces. Menos del 1% del aripiprazol inalterado se excretó en la orina y aproximadamente el 18% se recuperó inalterado en las heces.
Farmacocinética en grupos especiales de pacientes
Población pediátrica
La farmacocinética de aripiprazol y dehidroaripiprazol en pacientes pediátricos de 10 a 17 años fue similar a la de los adultos después de corregir las diferencias de peso corporal.
Personas mayores
No existen diferencias en la farmacocinética de aripiprazol entre sujetos sanos de edad avanzada y adultos jóvenes, ni tampoco se detectó ningún efecto de la edad en el análisis farmacocinético poblacional de pacientes esquizofrénicos.
Sexo
No existen diferencias en la farmacocinética de aripiprazol entre hombres y mujeres sanos ni se detectó ningún efecto del sexo en el análisis farmacocinético en una población de pacientes esquizofrénicos.
Humo y carrera
Una evaluación farmacocinética poblacional no reveló evidencia de diferencias clínicamente significativas relacionadas con la raza o efectos del tabaquismo sobre la farmacocinética de aripiprazol.
Enfermedad del riñon
Las características farmacocinéticas de aripiprazol y dehidroaripiprazol fueron similares en pacientes con enfermedad renal grave en comparación con sujetos jóvenes sanos.
Enfermedad del higado
En un estudio de dosis única en sujetos con diversos grados de cirrosis hepática (clases A, B y C de Child-Pugh), no se mostró un efecto significativo de la disfunción hepática sobre la farmacocinética de aripiprazol y dehidroaripiprazol, pero el estudio incluyó solo a 3 pacientes. con cirrosis hepática clase C, lo que no es suficiente para sacar conclusiones sobre su capacidad metabólica.
05.3 Datos preclínicos sobre seguridad
Los datos de seguridad de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad por dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción y el desarrollo.
Se observaron efectos significativos desde el punto de vista de la toxicidad solo a dosis o exposiciones muy superiores a las máximas en humanos, lo que indica que estos efectos tienen poca o ninguna relevancia clínica. Estos incluyeron: toxicidad adrenocortical dependiente de la dosis (acumulación de pigmento de lipofuscina y / o pérdida del parénquima celular) en ratas después de 104 semanas a dosis que varían de 20 a 60 mg / kg / día (3 a 10 veces el AUC medio en estado estacionario en dosis máxima recomendada en humanos) y aumento de carcinomas y carcinomas de corteza suprarrenal en combinación con adenomas adrenocorticales en ratas hembras a 60 mg / kg / día (10 veces el AUC medio en estado estacionario a la dosis máxima recomendada en el hombre).
La exposición no cancerígena más alta en ratas hembras fue 7 veces la exposición humana a la dosis recomendada.
Un hallazgo adicional fue la litiasis biliar como resultado de la precipitación de sulfoconjugados de hidroximetabolito de aripiprazol en la bilis de mono después de dosis orales repetidas que oscilan entre 25 y 125 mg / kg / día (1 a 3 veces el AUC medio en el estado estacionario a la dosis clínica máxima recomendada o 16 a 81 veces la dosis humana máxima recomendada en mg / m2). por encima del 6% de las concentraciones de bilis encontradas en los monos en el estudio de 39 semanas y están muy por debajo (6%) de sus límites de solubilidad. in vitro.
En estudios clínicos con dosis repetidas en ratas y perros jóvenes, el perfil de toxicidad de aripiprazol fue comparable al observado en animales adultos y no hubo evidencia de neurotoxicidad o reacciones adversas del desarrollo.
Según los resultados de un conjunto completo de pruebas de genotoxicidad estándar, el aripiprazol se considera no genotóxico. El aripiprazol no afectó la fertilidad en los estudios de toxicidad reproductiva. Se observaron signos de toxicidad para el desarrollo, incluida la osificación fetal retardada dependiente de la dosis y posibles efectos teratogénicos, en ratas a dosis que dieron lugar a exposiciones subterapéuticas (basadas en el AUC) y en conejos a dosis que dieron como resultado una exposición de 3 a 11 veces. estado estacionario a la dosis clínica máxima recomendada. La toxicidad materna se produjo en dosis similares a las que desencadenan la toxicidad del desarrollo del feto.
06.0 INFORMACIÓN FARMACÉUTICA
06.1 Excipientes
Lactosa monohidrato
Maicena
Celulosa microcristalina
Hidroxipropilcelulosa
Estearato de magnesio
Laca de aluminio índigo carmín (E132)
06.2 Incompatibilidad
Irrelevante.
06.3 Período de validez
3 años.
06.4 Precauciones especiales de conservación
Almacene en el paquete original para proteger el medicamento de la humedad.
06.5 Naturaleza del envase primario y contenido del envase.
Blísteres unidosis perforados de aluminio de 14 x 1, 28 x 1, 49 x 1, 56 x 1, 98 x 1 comprimidos.
Es posible que no se comercialicen todos los tamaños de envases.
06.6 Instrucciones de uso y manipulación
Los medicamentos no utilizados y los desechos derivados de este medicamento deben eliminarse de acuerdo con las regulaciones locales.
07.0 TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Otsuka Pharmaceutical Europe Ltd.
Galones, Wexham Springs, Framewood Road,
Wexham, SL3 6PJ - Reino Unido
08.0 NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU / 1/04/276 / 001-005
036582017
09.0 FECHA DE LA PRIMERA AUTORIZACIÓN O RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 4 de junio de 2004
Fecha de la última renovación: 4 de junio de 2009
10.0 FECHA DE REVISIÓN DEL TEXTO
D.CCE Febrero de 2015