Ingredientes activos: fluconazol
Diflucan 50 mg cápsulas duras
Diflucan 100 mg cápsulas duras
Diflucan 150 mg cápsulas duras
Diflucan 200 mg cápsulas duras
Los prospectos de Diflucan están disponibles para los siguientes tamaños de envase: - Diflucan 50 mg cápsulas duras, Diflucan 100 mg cápsulas duras, Diflucan 150 mg cápsulas duras, Diflucan 200 mg cápsulas duras,
- Diflucan 10 mg / ml polvo para suspensión oral
- Diflucan 2 mg / ml solución para perfusión
¿Por qué se usa Diflucan? ¿Para qué sirve?
Diflucan pertenece a un grupo de medicamentos denominados "antifúngicos". El ingrediente activo es fluconazol.
Diflucan se usa para tratar las infecciones por hongos y se puede usar para prevenir las infecciones por cándida. La causa más común de infecciones por hongos es una levadura llamada Candida.
Adultos
Su médico puede recetarle este medicamento para tratar las siguientes infecciones fúngicas:
- Meningitis criptocócica: una "infección fúngica del cerebro
- Coccidioidomicosis: una enfermedad del sistema broncopulmonar
- Infecciones causadas por Candida y que se encuentran en el torrente sanguíneo, los órganos (p. Ej., Corazón, pulmones) o el tracto urinario.
- Candidiasis de las mucosas: infección de la mucosa oral, infección de garganta e inflamación de la boca por prótesis dentales
- Candidiasis genital: infección de la vagina o el pene.
- Infecciones de la piel, por ejemplo, pie de atleta, tiña, picazón en el área genital, infecciones de las uñas.
Se le puede recetar Diflucan para:
- prevenir la recurrencia de la meningitis criptocócica
- prevenir la reaparición de la candidiasis mucosa
- Disminuir las recurrencias de candidiasis vaginal.
- prevenir las infecciones por Candida (si su sistema inmunológico está débil o no funciona correctamente)
Niños y adolescentes (0 a 17 años)
Su médico puede recetarle este medicamento para tratar las siguientes infecciones fúngicas:
- Candidiasis de las mucosas: infección de la mucosa oral, infección de la garganta.
- Infecciones causadas por Candida y que se encuentran en el torrente sanguíneo, los órganos (p. Ej., Corazón, pulmones) o el tracto urinario.
- Meningitis criptocócica: una "infección fúngica del cerebro
Se le puede recetar Diflucan para:
- prevenir las infecciones por Candida (si su sistema inmunológico está débil o no funciona correctamente)
- prevenir la recurrencia de la meningitis criptocócica
Contraindicaciones Cuándo no se debe usar Diflucan
No tome Diflucan
si es alérgico al fluconazol, a otros medicamentos que haya utilizado para tratar las infecciones por hongos oa cualquiera de los demás componentes de este medicamento. Sus síntomas pueden ser picazón, enrojecimiento de la piel o dificultad para respirar
- si toma astemizol, terfenadina (medicamentos antihistamínicos utilizados para tratar las alergias)
- si toma cisaprida (utilizada para tratar el malestar estomacal)
- si está tomando pimozida (utilizada para tratar trastornos mentales)
- si está tomando quinidina (utilizada para tratar arritmias cardíacas)
- si toma eritromicina (un antibiótico utilizado para tratar infecciones bacterianas)
Precauciones de uso Lo que necesita saber antes de tomar Diflucan
Consulte a su médico o farmacéutico antes de tomar Diflucan.
- si tiene problemas de hígado o riñón
- si tiene una enfermedad cardíaca, incluida arritmia cardíaca
- si tiene niveles anormales de potasio, calcio o magnesio en sangre
- si tiene reacciones cutáneas graves (picor, enrojecimiento de la piel o dificultad para respirar).
Interacciones ¿Qué medicamentos o alimentos pueden modificar el efecto de Diflucan?
Informe a su médico inmediatamente si está tomando
astemizol, terfenadina (antihistamínico usado para tratar alergias) o cisaprida (usado para tratar dolencias de estómago) o pimozida (usado para tratar trastornos mentales) o quinidina (usado para tratar arritmias cardíacas) o eritromicina (antibiótico usado para tratar infecciones bacterianas), ya que no se puede tomar con Diflucan.
Hay algunos medicamentos que pueden interactuar con Diflucan. Informe a su médico si está tomando alguno de los siguientes medicamentos:
- rifampicina o rifabutina (antibióticos para tratar infecciones bacterianas)
- alfentanilo, fentanilo (anestésicos)
- amitriptilina, nortriptilina (antidepresivos)
- anfotericina B, voriconazol (antifúngicos)
- medicamentos que diluyen la sangre para prevenir la formación de coágulos (warfarina o medicamentos similares)
- benzodiazepinas (midazolam, triazolam o medicamentos similares) utilizados para ayudarle a dormir o para la ansiedad
- carbamazepina, fenitoína (utilizados para tratar las convulsiones)
- nifedipino, isradipino, amlodipino, felodipino y losartán (usados para tratar la hipertensión - presión arterial alta)
- ciclosporina, everolimus, sirolimus o tacrolimus (utilizados para prevenir el rechazo del trasplante)
- ciclofosfamida, alcaloides de la vinca (vincristina, vinblastina o medicamentos similares) utilizados para tratar el cáncer
- halofantrina (utilizada para tratar la malaria)
- estatinas (atorvastatina, simvastatina, fluvastatina y medicamentos similares) utilizados para reducir los niveles altos de colesterol
- metadona (utilizada para tratar el dolor)
- celecoxib, flurbiprofeno, naproxeno, ibuprofeno, lornoxicam, meloxicam, diclofenaco (medicamentos antiinflamatorios no esteroideos - AINE)
- anticonceptivos orales
- prednisona (esteroide)
- zidovudina, también conocida como AZT; saquinavir (utilizado en pacientes con VIH)
- medicamentos para la diabetes como clorpromamida, glibenclamida, glipizida o tolbutamida
- teofilina (utilizada para controlar el asma)
- vitamina A (complemento alimenticio)
- ivacaftor (utilizado para tratar la fibrosis quística)
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Advertencias Es importante saber que:
Toma de Diflucan con alimentos y bebidas
Puede tomar el medicamento con o sin comida.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Puede continuar amamantando después de tomar una dosis única de Diflucan hasta 200 mg.
No debe amamantar si está tomando dosis repetidas de Diflucan.
Conducción y uso de máquinas
Debe tenerse en cuenta que pueden producirse mareos o convulsiones al conducir o utilizar maquinaria.
Diflucan contiene lactosa (azúcar de la leche)
Este medicamento contiene una pequeña cantidad de lactosa (azúcar de la leche). Si su médico le ha dicho que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
Dosis, método y momento de administración Cómo usar Diflucan: Posología
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte a su médico o farmacéutico.
Trague la cápsula entera con un vaso de agua. Es mejor tomar las cápsulas a la misma hora todos los días.
Las dosis recomendadas de este medicamento que se deben tomar en función de la infección se enumeran a continuación:
Adultos
Adolescentes de 12 a 17 años
Tome siempre la dosis recetada por su médico (o la dosis para adultos o niños).
Niños hasta 11 años
La dosis máxima en niños es de 400 mg por día.
La dosis se basará en el peso del niño en kilogramos.
Uso en niños de 0 a 4 semanas.
Uso en niños de 3 a 4 semanas:
La misma dosis que la descrita anteriormente pero administrada una vez cada 2 días. La dosis máxima es de 12 mg por kg de peso corporal cada 48 horas.
Uso en bebés menores de 2 semanas de edad:
La misma dosis que la descrita anteriormente, pero administrada una vez cada 3 días. La dosis máxima es de 12 mg por kg de peso corporal cada 72 horas. Pacientes de edad avanzada Se debe utilizar la misma dosis que para los adultos a menos que tenga problemas renales.
Pacientes con problemas renales
Su médico puede ajustar la dosis en función de su función renal.
Sobredosis Qué hacer si ha tomado demasiado Diflucan
Tomar demasiadas cápsulas a la vez podría causarle problemas. Comuníquese con su médico de inmediato o acuda al hospital más cercano. En el caso de una sobredosis accidental, los síntomas pueden incluir oír, ver, sentir y pensar cosas que no son reales (alucinaciones y comportamiento paranoico). El tratamiento sintomático (con medidas de soporte adecuadas y posiblemente lavado gástrico) puede ser apropiado.
Si olvidó tomar Diflucan
No tome una dosis doble para compensar las dosis olvidadas. Si olvidó tomar una dosis, tómela lo antes posible. Si es hora de su próxima dosis, omita la dosis olvidada.
Si tiene más preguntas sobre el uso de este medicamento, consulte a su médico o farmacéutico.
Efectos secundarios ¿Cuáles son los efectos secundarios de Diflucan?
Como todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Algunas personas experimentan reacciones alérgicas, aunque raras veces se producen reacciones alérgicas graves. Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluidos los posibles efectos adversos que no aparecen en este prospecto. Si experimenta alguno de los siguientes síntomas, informe a su médico de inmediato.
- sibilancias repentinas, dificultad para respirar u opresión en el pecho
- hinchazón de los párpados, la cara o los labios
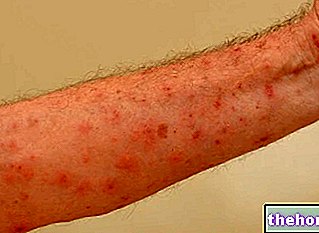
- picazón en todo el cuerpo, piel roja o manchas rojas que pican
- erupciones en la piel
- reacciones cutáneas graves, por ejemplo, una erupción que causa ampollas (puede afectar la boca y la lengua).
Diflucan puede afectar al hígado. Los síntomas de problemas hepáticos incluyen:
- cansancio
- pérdida de apetito
- Él vomitó
- coloración amarillenta de la piel y el blanco de los ojos (ictericia)
Si tiene alguno de estos síntomas, deje de tomar Diflucan e informe a su médico de inmediato.
Otros efectos secundarios
Si alguno de los efectos adversos se agrava o si nota cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Los efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas) son:
- dolor de cabeza
- malestar estomacal, diarrea, náuseas, vómitos
- aumento de los valores de la función hepática en los análisis de sangre
- erupciones en la piel.
Los efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas) son:
- reducción de los glóbulos rojos que puede causar palidez, debilidad o dificultad para respirar
- disminucion del apetito
- insomnio, somnolencia
- convulsiones, mareos, sensación de vértigo, hormigueo, pinchazos o entumecimiento, cambio en el gusto
- estreñimiento, dificultad para digerir, flatulencia, sequedad de boca
- dolor muscular
- daño hepático y coloración amarillenta de la piel y los ojos (ictericia)
- hinchazón, ampollas (urticaria) picor, aumento de la sudoración
- fatiga, malestar general, fiebre.
Los efectos adversos raros (pueden afectar hasta 1 de cada 1.000 personas) son:
- niveles más bajos de lo normal de glóbulos blancos, que ayudan a defenderse de las infecciones, y plaquetas, que hacen posible que la sangre se coagule
- cambio en la decoloración de la piel (rojo o violáceo) que puede ser causado por una reducción de las plaquetas, otros cambios en las células sanguíneas
- cambios en la composición química de la sangre (niveles altos de colesterol, grasas)
- niveles bajos de potasio en sangre
- escalofríos
- electrocardiograma (ECG) alterado, cambio en el ritmo y la frecuencia cardíaca
- insuficiencia hepática
- reacciones alérgicas (a veces graves), que incluyen erupción con ampollas y descamación generalizadas de la piel, reacciones cutáneas graves, hinchazón de los labios y la cara
- perdida de cabello.
Notificación de efectos secundarios
Si experimenta algún efecto adverso, consulte a su médico, farmacéutico o enfermero. Esto incluye cualquier posible efecto adverso que no se mencione en este prospecto. También puede notificar los efectos adversos directamente a través del sistema nacional de notificación. .Agenziafarmaco.gov.it / it / responsable. Al informar los efectos secundarios, puede ayudar a proporcionar más información sobre la seguridad de este medicamento.
Caducidad y retención
- Mantenga este medicamento fuera de la vista y del alcance de los niños.
- No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta después de CAD. La fecha de caducidad se refiere al último día de ese mes.
- Conservar por debajo de 30 ° C.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita, ya que esto ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
Qué contiene Diflucan
- El ingrediente activo es fluconazol.
- Cada cápsula dura contiene 50 mg, 100 mg, 150 mg o 200 mg de fluconazol.
- Los excipientes son:
Contenido de la cápsula: lactosa monohidrato, almidón de maíz, sílice coloidal anhidra, estearato de magnesio y lauril sulfato de sodio.
Aspecto de Diflucan y contenido del envase
- Las cápsulas duras de Diflucan 50 mg tienen un cuerpo blanco y una tapa turquesa. Han impreso "Pfizer" y el código "FLU-50" en tinta negra.
- Las cápsulas duras de Diflucan 100 mg tienen un cuerpo blanco y una tapa azul. Han impreso "Pfizer" y el código "FLU-100" en tinta negra.
- Las cápsulas duras de Diflucan 150 mg tienen un cuerpo turquesa y una tapa turquesa. Llevan impreso "Pfizer" y el código "FLU-150" en tinta negra.
- Las cápsulas duras de Diflucan 200 mg tienen un cuerpo blanco y una tapa violeta. Llevan impresas, con tinta negra, las palabras "Pfizer" y el código "FLU-200"
- Diflucan 50 mg, 100 mg, 150 mg y 200 mg están disponibles en envases que contienen 1, 2, 3, 4, 6, 7, 10, 12, 14, 20, 28, 30, 42, 50, 60, 100 o 500 cápsulas duras.
Es posible que no se comercialicen todos los tamaños de envases.
Prospecto fuente: AIFA (Agencia Italiana de Medicamentos). Contenido publicado en enero de 2016. Es posible que la información presente no esté actualizada.
Para tener acceso a la versión más actualizada, es recomendable acceder al sitio web de la AIFA (Agencia Italiana de Medicamentos). Descargo de responsabilidad e información útil.
01.0 NOMBRE DEL MEDICAMENTO
CÁPSULAS DIFLUCAN DURAS
02.0 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene 50 mg de fluconazol.
Excipientes: Cada cápsula dura también contiene 49,70 mg de lactosa monohidrato.
Cada cápsula dura contiene 100 mg de fluconazol.
Excipientes: Cada cápsula dura también contiene 99,41 mg de lactosa monohidrato.
Cada cápsula dura contiene 150 mg de fluconazol.
Excipientes: Cada cápsula dura también contiene 149,12 mg de lactosa monohidrato.
Cada cápsula dura contiene 200 mg de fluconazol.
Excipientes: Cada cápsula dura también contiene 198,82 mg de lactosa monohidrato.
Para consultar la lista completa de excipientes, ver sección 6.1.
03.0 FORMA FARMACÉUTICA
Cápsula dura.
La cápsula de gelatina dura de 50 mg tiene un cuerpo blanco y una tapa turquesa marcada con "Pfizer" y el código "FLU-50" en tinta negra. El tamaño de la cápsula es n. ° 4.
La cápsula de gelatina dura de 100 mg tiene un cuerpo blanco y una tapa azul en la que están impresos "Pfizer" y el código "FLU-100" con tinta negra. El tamaño de la cápsula es el n. ° 2.
La cápsula de gelatina dura de 150 mg tiene un cuerpo turquesa y una tapa turquesa marcada con "Pfizer" y el código "FLU-150" en tinta negra. El tamaño de la cápsula es el n. ° 1.
La cápsula de gelatina dura de 200 mg tiene un cuerpo blanco y una tapa violeta marcada con "Pfizer" y el código "FLU-200" en tinta negra. El tamaño de la cápsula es n. 0.
04.0 INFORMACIÓN CLÍNICA
04.1 Indicaciones terapéuticas
Diflucan está indicado en las siguientes infecciones fúngicas (ver sección 5.1).
Diflucan está indicado en adultos para el tratamiento de:
• Meningitis criptocócica (ver sección 4.4).
• Coccidioidomicosis (ver sección 4.4).
• Candidiasis invasiva.
• Candidiasis de las mucosas, que incluye candidiasis orofaríngea, candidiasis esofágica, candiduria y candidiasis mucocutánea crónica.
• Candidiasis oral atrófica crónica (estomatitis de prótesis dentales), cuando la higiene dental y el tratamiento tópico son insuficientes.
• Candidiasis vaginal, aguda o recurrente, cuando la terapia local no es apropiada.
• Balanitis por Candidacuando la terapia local no es apropiada.
• Dermatomicosis, que incluye tinea pedis, tinea corporis, tiña crural, tiña versicolor e infecciones de la piel por Candida, cuando está indicada la terapia sistémica.
• Tiña unguinium (onicomicosis), cuando otros tratamientos no se consideran apropiados.
Diflucan está indicado en adultos para la profilaxis de:
• Recurrencia de meningitis criptocócica en pacientes con alto riesgo de recaída.
• Recurrencia de candidiasis orofaríngea o esofágica en pacientes infectados por el VIH con alto riesgo de recaída.
• Reducir la incidencia de candidiasis vaginal recurrente (4 o más episodios por año).
• Profilaxis de la candidemia en pacientes con neutropenia prolongada (por ejemplo, pacientes con enfermedades hematológicas malignas sometidos a quimioterapia o pacientes que reciben un trasplante de células madre hematopoyéticas (ver sección 5.1)).
Diflucan está indicado en recién nacidos a término, lactantes, lactantes, niños y adolescentes de 0 a 17 años:
Diflucan se utiliza en el tratamiento de la candidiasis de las mucosas (orofaríngea y esofágica), candidiasis invasiva, meningitis criptocócica y en la profilaxis de la candidiasis en pacientes inmunodeprimidos. Diflucan se puede utilizar como terapia de mantenimiento para prevenir la recaída de la meningitis criptocócica en niños con alto riesgo de recaída (ver sección 4.4).
La terapia se puede instituir antes de que se conozcan los resultados del cultivo u otras pruebas de laboratorio, pero cuando los resultados estén disponibles, la terapia antiinfecciosa debe ajustarse en consecuencia.
Se deben considerar las pautas oficiales para el uso apropiado de antifúngicos.
04.2 Posología y forma de administración
Dosis
La dosis debe basarse en la naturaleza y la gravedad de la infección por hongos. El tratamiento de las infecciones que requieren dosis múltiples debe continuar hasta que los parámetros clínicos u otras pruebas de laboratorio demuestren que la infección por hongos activa ha desaparecido. Un período de tratamiento inadecuado podría provocar la reaparición de la infección activa.
Adultos
Poblaciones especiales
Personas mayores
La dosis debe ajustarse en función de la función renal (ver "Insuficiencia renal').
Insuficiencia renal
No se requieren ajustes al realizar una terapia de dosis única. Sin embargo, cuando se utilice un tratamiento con dosis repetidas de fluconazol en pacientes con insuficiencia renal (incluida la población pediátrica), se debe administrar una dosis inicial de entre 50 mg y 400 mg, basada en la dosis diaria recomendada para la indicación. la dosis diaria (según la indicación) debe modificarse de acuerdo con el siguiente esquema:
Los pacientes en diálisis regular deben recibir el 100% de la dosis recomendada después de cada sesión de diálisis; en los días sin diálisis, los pacientes deben recibir una dosis reducida según el aclaramiento de creatinina.
Deterioro hepático
Se dispone de datos limitados en pacientes con insuficiencia hepática, por lo que fluconazol debe administrarse con precaución en pacientes con insuficiencia hepática (ver secciones 4.4 y 4.8).
Población pediátrica
En la población pediátrica no debe excederse la dosis máxima de 400 mg / día.
Como ocurre con infecciones similares en adultos, la duración del tratamiento se basa en la respuesta clínica y micológica. Diflucan se administra en una sola dosis diaria.
Para pacientes pediátricos con insuficiencia renal, consulte la posología en "Insuficiencia renal". La farmacocinética de fluconazol no se ha estudiado en la población pediátrica con insuficiencia renal (para "recién nacidos a término" que a menudo muestran principalmente inmadurez renal, ver más abajo).
Lactantes, lactantes y niños (28 días a 11 años):
Adolescentes (12 a 17 años)
Según el peso y el desarrollo puberal, el médico deberá evaluar qué posología es la más adecuada (adultos o niños). Los datos clínicos indican que los niños tienen un aclaramiento de fluconazol más alto que el que se encuentra en los adultos. Una dosis de 100, 200 y 400 mg en adultos corresponde a una dosis de 3, 6 y 12 mg / kg en niños, para lograr una exposición sistémica comparable.
No se ha establecido la seguridad y eficacia para la indicación de candidiasis genital en la población pediátrica. Los datos de seguridad actualmente disponibles para otras indicaciones pediátricas se describen en la sección 4.8. En los casos en los que el tratamiento de la candidiasis genital en adolescentes (de 12 a 17 años) sea absolutamente necesario, la dosis debe ser la misma que para los adultos.
Lactantes a término (0 a 27 días)
La excreción de fluconazol en los recién nacidos se produce de forma lenta y existen pocos datos farmacocinéticos que respalden esta posología en recién nacidos a término (ver sección 5.2).
Método de administración
Diflucan se puede administrar por vía oral o por infusión intravenosa, dependiendo del estado clínico del paciente. Al cambiar de la vía intravenosa a la oral, o viceversa, no es necesario cambiar la dosis diaria.
Las cápsulas deben tragarse enteras e independientemente de la ingesta de alimentos.
04.3 Contraindicaciones
Hipersensibilidad al principio activo, a los compuestos azólicos relacionados oa alguno de los excipientes (ver sección 6.1).
La administración concomitante de terfenadina está contraindicada en pacientes que reciben tratamiento con dosis múltiples de Diflucan ≥ 400 mg / día según los resultados de un estudio de interacción de dosis múltiples. La administración concomitante de otros fármacos que prolongan el intervalo QT y se metabolizan a través del citocromo P450 (CYP) 3A4, como cisaprida, astemizol, pimozida, quinidina y eritromicina, está contraindicada en pacientes que reciben tratamiento con fluconazol (ver secciones 4.4 y 4.5).
04.4 Advertencias especiales y precauciones de uso apropiadas
Tiña de la cabeza
El fluconazol se ha estudiado para el tratamiento de tiña de la cabeza en ninos. Se demostró que no era superior a la griseofulvina y la tasa de éxito global fue inferior al 20%. Por tanto, Diflucan no debe utilizarse para tiña de la cabeza.
Criptococosis
La evidencia de la eficacia del fluconazol en el tratamiento de la criptococosis de otros sitios (p. Ej., Criptococosis cutánea y pulmonar) es limitada y, por lo tanto, no es posible realizar recomendaciones posológicas.
Micosis endémicas profundas
La evidencia de la eficacia del fluconazol en el tratamiento de micosis endémicas profundas como la paracoccidioidomicosis, la esporotricosis linfocutánea y la histoplasmosis es limitada y, por lo tanto, no es posible realizar recomendaciones posológicas.
Sistema renal
Diflucan debe administrarse con precaución a pacientes con insuficiencia renal (ver sección 4.2).
Sistema hepatobiliar
Diflucan debe administrarse con precaución a pacientes con insuficiencia hepática (ver sección 4.2).
Diflucan se ha asociado con casos raros de toxicidad hepática grave, a veces mortal, especialmente en pacientes con una enfermedad subyacente grave. En los casos de hepatotoxicidad asociada con fluconazol no fue posible establecer una relación con la dosis diaria utilizada, la duración del tratamiento, el sexo o la edad del paciente. La hepatotoxicidad del fluconazol fue generalmente reversible al suspender el tratamiento.
Los pacientes que presenten anomalías en la función hepática durante el tratamiento con fluconazol deben ser controlados cuidadosamente por la posible aparición de daños hepáticos más graves.
Se debe informar a los pacientes de los síntomas indicativos de efectos hepáticos graves (astenia significativa, anorexia, náuseas persistentes, vómitos e ictericia). El tratamiento con fluconazol debe interrumpirse inmediatamente y el paciente debe consultar al médico.
Sistema cardiovascular
Algunos azoles, incluido el fluconazol, se han asociado con una prolongación del intervalo QT en el electrocardiograma. Durante la fase de poscomercialización, se han producido casos muy raros de prolongación del intervalo QT y torsades de pointes en pacientes que tomaban Diflucan. Estos casos incluyeron pacientes gravemente enfermos con múltiples factores de riesgo de confusión, como cardiopatía estructural, anomalías, electrolitos y medicamentos concomitantes que puede haber contribuido a las anomalías del ritmo.
Diflucan debe administrarse con precaución a pacientes con estas posibles condiciones proarrítmicas. La administración concomitante de otros medicamentos que prolongan el intervalo QT y se metabolizan a través del citocromo P450 (CYP) 3A4 está contraindicada (ver secciones 4.3 y 4.5).
Halofantrina
Se ha demostrado que la halofantrina prolonga el intervalo QTc a la dosis terapéutica recomendada y es un sustrato del CYP3A4. Por tanto, no se recomienda el uso concomitante de fluconazol y halofantrina (ver sección 4.5).
Reacciones dermatologicas
Con el tratamiento con fluconazol se han producido episodios raros de reacciones cutáneas exfoliativas, como el síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica. Los pacientes con SIDA son más propensos a desarrollar reacciones cutáneas graves a muchos medicamentos. Si aparece una erupción cutánea atribuible a fluconazol en un paciente que recibe fluconazol para infecciones micóticas superficiales, se debe interrumpir el tratamiento con este medicamento. Si los pacientes con infecciones fúngicas invasivas / sistémicas desarrollan erupción cutánea, deben ser controlados cuidadosamente y se debe interrumpir el tratamiento con fluconazol si se desarrollan lesiones ampollosas o eritema multiforme.
Hipersensibilidad
En raras ocasiones se ha notificado anafilaxia (ver sección 4.3).
Citocromo P450
El fluconazol inhibe de forma potente el citocromo CYP2C9 e inhibe moderadamente el citocromo CYP3A4. El fluconazol también inhibe el citocromo CYP2C19. Se debe monitorizar a los pacientes tratados con Diflucan que sean tratados concomitantemente con fármacos que tienen una ventana terapéutica estrecha y se metabolizan a través de CYP2C9, CYP2C19 y CYP3A4 (ver sección 4.5).
Terfenadina
Debe vigilarse estrechamente la administración concomitante de fluconazol a dosis inferiores a 400 mg / día y terfenadina (ver secciones 4.3 y 4.5).
Excipientes
Las cápsulas contienen lactosa monohidrato. Los pacientes con intolerancia hereditaria a galactosa, deficiencia de lactasa o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
04.5 Interacciones con otros medicamentos y otras formas de interacción
El uso concomitante de los siguientes medicamentos está contraindicado
Cisaprida
Ha habido informes de eventos cardíacos que incluyen torsades de pointes en pacientes que recibieron la administración concomitante de fluconazol y cisaprida. Un estudio controlado informó que la administración concomitante de 200 mg de fluconazol una vez al día y 20 mg de cisaprida cuatro veces al día produce un aumento significativo de los niveles plasmáticos de cisaprida y una prolongación del intervalo QTc. La administración concomitante de cisaprida y fluconazol está contraindicada (ver sección 4.3).
Terfenadina
Se han realizado estudios de interacción tras la aparición de arritmias graves tras la prolongación del intervalo QTc en pacientes que recibieron otros antifúngicos azólicos y terfenadina. Un estudio realizado con una dosis diaria de 200 mg de fluconazol no demostró una prolongación del intervalo QTc. Otro estudio con dosis diarias de fluconazol de 400 mg y 800 mg mostró que la administración de fluconazol en dosis de 400 mg / día o superiores aumentaba significativamente los niveles plasmáticos de terfenadina cuando se administraba concomitantemente. El uso concomitante de fluconazol a dosis de 400 mg / día o más y terfenadina está contraindicado (ver sección 4.3). La administración concomitante de fluconazol a dosis inferiores a 400 mg / día y terfenadina debe ser monitoreada de cerca.
Astemizol
El uso concomitante de fluconazol y astemizol puede reducir el aclaramiento de astemizol. Los aumentos resultantes de las concentraciones plasmáticas de astemizol pueden provocar una prolongación del intervalo QT y la aparición de casos raros de torsades de pointes. La administración concomitante de fluconazol y astemizol está contraindicada (ver sección 4.3).
Pimozida
Incluso si no ha sido estudiado in vitro o en vivo, la administración concomitante de fluconazol y pimozida puede producir la inhibición del metabolismo de pimozida. Los aumentos resultantes de las concentraciones plasmáticas pueden provocar una prolongación del intervalo QT y la aparición de casos raros de torsades de pointes. La administración concomitante de fluconazol y pimozida está contraindicada (ver sección 4.3).
Quinidina
Incluso si no ha sido estudiado in vitro o en vivo, la administración concomitante de fluconazol y quinidina puede producir la inhibición del metabolismo de la quinidina. El uso de quinidina se ha asociado con la prolongación del intervalo QT y la aparición de casos raros de torsades de pointes. La administración concomitante de fluconazol y quinidina está contraindicada ( ver sección 4.3).
Eritromicina
El uso concomitante de fluconazol y eritromicina podría aumentar el riesgo de cardiotoxicidad (prolongación del intervalo QT, torsades de pointes) y, por tanto, de muerte súbita cardíaca. La administración concomitante de fluconazol y eritromicina está contraindicada (ver sección 4.3).
No se recomienda el uso concomitante de los siguientes medicamentos
Halofantrina
El fluconazol puede aumentar las concentraciones plasmáticas de halofantrina debido al efecto inhibidor sobre CYP3A4. El uso concomitante de fluconazol y halofantrina podría aumentar el riesgo de cardiotoxicidad (prolongación del intervalo QT, torsades de pointes) y, por lo tanto, de muerte súbita cardíaca. Por tanto, debe evitarse el uso de estos dos fármacos en combinación (ver sección 4.4).
El uso concomitante de los siguientes medicamentos implica precauciones y ajustes de dosis.
Efectos de otros medicamentos sobre fluconazol
Rifampicina
La administración concomitante de fluconazol y rifampicina resultó en una reducción del 25% en el AUC y una reducción del 20% en la vida media del fluconazol. Por tanto, en pacientes que toman rifampicina concomitante, se debe considerar un aumento de la dosis de fluconazol.
Los estudios de interacción han demostrado que no se producen cambios clínicamente significativos en la absorción de fluconazol durante la administración concomitante de fluconazol con alimentos, cimetidina, antiácidos o después de la irradiación corporal total para el trasplante de médula ósea.
Efectos del fluconazol sobre otros medicamentos
El fluconazol es un potente inhibidor de la isoenzima 2C9 del citocromo P450 (CYP) y un inhibidor moderado de la isoenzima CYP3A4. El fluconazol también es un inhibidor de la isoenzima CYP2C19. Además de las interacciones observadas / documentadas que se enumeran a continuación, existe el riesgo de un aumento de las concentraciones plasmáticas de otros compuestos metabolizados por las isoenzimas CYP2C9 y CYP3A4 administradas en combinación con fluconazol. Por lo tanto, se debe tener gran precaución. cuando se prescriben estas combinaciones y se controla de cerca a los pacientes El efecto inhibidor de fluconazol sobre la enzima permanece 4-5 días después de la interrupción del tratamiento debido a la larga vida media de fluconazol (ver sección 4.3).
Alfentanilo
Durante el tratamiento concomitante con fluconazol intravenoso (400 mg) y alfentanilo intravenoso (20 mcg / kg) en voluntarios sanos, el AUC de alfentanilo se duplicó, posiblemente debido a la inhibición del CYP3A4. Puede ser necesario ajustar la dosis. De alfentanilo.
Amitriptilina, nortriptilina
El fluconazol aumenta el efecto de la amitriptilina y la nortriptilina. La 5-nortriptilina y / o la S-amitriptilina se pueden medir al inicio de la terapia concomitante y después de una semana de tratamiento. Si es necesario, se debe ajustar la dosis de amitriptilina / nortriptilina.
Anfotericina B
La administración concomitante de fluconazol y anfotericina B en ratones normales e inmunosuprimidos infectados mostró los siguientes resultados: un efecto antifúngico aditivo leve en infecciones sistémicas debidas a C. albicans, no hay interacción en infecciones intracraneales de Cryptococcus neoformans, y antagonismo de los dos fármacos en infecciones sistémicas por A. fumigatus. Se desconoce la importancia clínica de los resultados obtenidos en estos estudios.
Anticoagulantes
En la experiencia postcomercialización, al igual que con otros antifúngicos azoles, se han notificado episodios hemorrágicos (contusiones, epistaxis, hemorragia gastrointestinal, hematuria y melena) asociados con la prolongación del tiempo de protrombina en pacientes que reciben tratamiento concomitante con fluconazol y warfarina. y warfarina, el tiempo de protrombina se prolongó al doble, posiblemente debido a la inhibición del metabolismo de la warfarina a través de CYP2C9. En pacientes que reciben anticoagulantes cumarínicos de forma concomitante con fluconazol, se debe controlar cuidadosamente el tiempo de protrombina. También puede ser necesario un ajuste de la dosis de warfarina.
Benzodiazepinas (efecto rápido), p. Ej. midazolam, triazolam
Después de la administración concomitante de midazolam oral y fluconazol, se observaron aumentos marcados en las concentraciones de midazolam y efectos psicomotores. La ingesta concomitante de fluconazol 200 mg y midazolam 7,5 mg por vía oral aumentó el AUC y la vida media del midazolam en 3,7 y 2,2 veces, respectivamente. El fluconazol 200 mg / día administrado concomitantemente con triazolam 0, 25 mg por vía oral aumentó el AUC y la mitad vida útil del triazolam en 4,4 y 2,3 veces, respectivamente. Durante el tratamiento concomitante con fluconazol, se observó una potenciación y prolongación de los efectos del triazolam. Cuando se requiera tratamiento concomitante con benzodiazepinas en pacientes que reciben fluconazol, se debe reducir la dosis de benzodiazepinas y realizar una monitorización adecuada del paciente. considerado.
Carbamazepina
El fluconazol inhibe el metabolismo de la carbamazepina y se ha observado un aumento del 30% en los niveles séricos de carbamazepina. Existe el riesgo de que se desarrolle un efecto tóxico de la carbamazepina. Es posible que se requieran ajustes en la dosis de carbamazepina según las mediciones y / o el efecto de las concentraciones.
Bloqueadores de los canales de calcio
Algunos bloqueadores de los canales de calcio (nifedipino, isradipino, amlodipino, verapamilo y felodipino) son metabolizados por CYP3A4. El fluconazol puede aumentar la exposición sistémica de los bloqueadores de los canales de calcio, por lo que se recomienda una monitorización frecuente de efectos adversos.
Celecoxib
Durante el tratamiento concomitante con fluconazol (200 mg / día) y celecoxib (200 mg), la Cmáx y el AUC de celecoxib aumentaron en un 68% y 134%, respectivamente. En combinación con fluconazol, es posible que sea necesario reducir la dosis de celecoxib a la mitad.
Ciclofosfamida
El tratamiento concomitante con ciclofosfamida y fluconazol produce un aumento de la bilirrubina sérica y la creatinina sérica. Los dos fármacos se pueden utilizar en combinación, siempre que se tenga en cuenta el riesgo derivado del aumento de los niveles de creatinina y bilirrubina sérica.
Fentanilo
Se ha notificado un caso mortal de intoxicación por fentanilo debido a la posible interacción entre fentanilo y fluconazol. Además, se encontró que fluconazol retrasa significativamente la eliminación de fentanilo en voluntarios sanos. Las concentraciones elevadas de fentanilo pueden provocar depresión respiratoria. Los pacientes deben ser monitoreados de cerca por el riesgo potencial de depresión respiratoria. Pueden ser necesarios ajustes de dosis. Fentanilo.
Inhibidores de la HMG-CoA reductasa
El riesgo de miopatía y rabdomiólisis aumenta cuando fluconazol se coadministra con inhibidores de la HMG-CoA reductasa metabolizada por CYP3A4, como atorvastatina y simvastatina, o CYP2C9, como fluvastatina. Si es necesaria la administración concomitante, se debe vigilar al paciente ya que pueden aparecer síntomas de miopatía y rabdomiólisis, y se debe vigilar la creatinina quinasa. La administración de inhibidores de la HMG-CoA reductasa debe suspenderse si se encuentra un aumento significativo de la creatinina quinasa o si se diagnostica o sospecha miopatía o rabdiomiolisis.
Inmunosupresores (por ejemplo, ciclosporina, everolimus, sirolimus y tacrolimus)
Ciclosporina: Fluconazol aumenta significativamente la concentración y el AUC de ciclosporina Se produjo un aumento de 1,8 en el AUC de ciclosporina durante el tratamiento concomitante de fluconazol 200 mg / día y ciclosporina (2,7 mg / kg / día). Los dos medicamentos se pueden usar en combinación, reduciendo la dosis de ciclosporina en función de la concentración de ciclosporina en sí.
Everolimus: aunque no hay estudios disponibles en vivo o in vitro, el fluconazol puede aumentar las concentraciones séricas de everolimus mediante la inhibición de CYP3A4.
Sirolimus: El fluconazol aumenta las concentraciones plasmáticas de sirolimus, presumiblemente inhibiendo el metabolismo de sirolimus a través del CYP3A4 y la glicoproteína P. Los dos fármacos se pueden utilizar en combinación con un ajuste de dosis de sirolimus, según los análisis de efecto / concentración.
Tacrolimus: Fluconazol puede aumentar las concentraciones séricas de tacrolimus administrado por vía oral hasta 5 veces debido a la inhibición del metabolismo de tacrolimus a través de CYP3A4 en el intestino. No se encontraron alteraciones farmacocinéticas significativas con la administración intravenosa de tacrolimus. Las elevaciones de los niveles de tacrolimus se han asociado con nefrotoxicidad.La dosis de tacrolimus administrado por vía oral debe reducirse en función de las concentraciones de tacrolimus en sí.
Losartán
El fluconazol inhibe el metabolismo de losartán a su metabolito activo (E-31 74), que es la base de gran parte de la actividad antagonista del receptor de angiotensina II que se produce durante el tratamiento con losartán. Los pacientes deben ser monitoreados continuamente para determinar la presión arterial.
Metadona
El fluconazol puede potenciar las concentraciones séricas de metadona. Es posible que sea necesario ajustar la dosis de metadona.
Medicamentos antiinflamatorios no esteroides (AINE)
La Cmáx y el AUC de flurbiprofeno aumentaron un 23% y un 81%, respectivamente, cuando se administraron en combinación con fluconazol, en comparación con la administración de flurbiprofeno solo. De manera similar, la Cmáx y el AUC del isómero farmacológicamente activo [S - (+) - ibuprofeno] aumentaron en un 15% y 82%, respectivamente, cuando se administró fluconazol en combinación con ibuprofeno racémico (400 mg) en comparación con la administración de ibuprofeno racémico solo.
Aunque no se han realizado estudios específicos, fluconazol puede aumentar la exposición sistémica de otros AINE metabolizados por CYP2C9 (p. Ej., Naproxeno, lornoxicam, meloxicam, diclofenaco). Se recomienda una monitorización frecuente de reacciones adversas y toxicidad relacionada con AINE. Se pueden realizar ajustes de dosis de AINE. requerido.
Fenitoína
El fluconazol inhibe el metabolismo hepático de la fenitoína. La administración concomitante repetida de 200 mg de fluconazol y 250 mg de fenitoína por vía intravenosa provocó un aumento del 75% en el AUC24 de la fenitoína y del 128% de la Cmín. En caso de administración concomitante, se deben controlar las concentraciones séricas de fenitoína para evitar la toxicidad de la fenitoína.
Prednisona
Hubo un informe de caso de un paciente con trasplante de hígado que recibió prednisona y que desarrolló insuficiencia adrenocortical aguda después de suspender el tratamiento con fluconazol durante tres meses. La interrupción del fluconazol presumiblemente resultó en un aumento de la actividad de CYP3A4, lo que condujo a un aumento en el metabolismo de prednisona. Los pacientes en tratamiento a largo plazo con fluconazol y prednisona deben ser monitoreados cuidadosamente por la posible aparición de insuficiencia adrenocortical después de la interrupción del tratamiento con fluconazol.
Rifabutina
El fluconazol aumenta las concentraciones séricas de rifabutina, lo que resulta en un aumento del AUC de rifabutina hasta en un 80%. Se han notificado casos de uveítis en pacientes en tratamiento concomitante con fluconazol y rifabutina. Por tanto, los síntomas de toxicidad por rifabutina deben tenerse en cuenta en el tratamiento combinado.
Saquinavir
El fluconazol aumenta el AUC y la Cmáx de saquinavir en aproximadamente un 50% y 55%, respectivamente, debido a la inhibición del metabolismo hepático de saquinavir por CYP3A4 y la inhibición de la glicoproteína P. La interacción con saquinavir / ritonavir no se ha estudiado y puede ser más pronunciada. Es posible que se requieran ajustes de dosis de saquinavir.
Sulfonilureas
El fluconazol administrado a voluntarios sanos produjo una prolongación de la semivida sérica de las sulfonilureas administradas concomitantemente por vía oral (clorpropamida, glibenclamida, glipizida y tolbutamida). Durante la administración concomitante, monitorización frecuente de los niveles de glucosa en sangre y reducción adecuada de la dosis de sulfonilurea. .
Teofilina
En un estudio de interacción controlado con placebo, la administración de 200 mg de fluconazol durante 14 días resultó en una reducción del 18% en el aclaramiento plasmático medio de teofilina. Los pacientes en tratamiento con dosis altas de teofilina o que tienen un mayor riesgo de episodios de toxicidad inducidos por teofilina deben ser monitoreados de cerca para detectar signos de toxicidad por teofilina cuando toman fluconazol concomitantemente, y el tratamiento debe ajustarse en consecuencia si ocurren tales signos.
Alcaloides de la vinca
Aunque no se han realizado estudios específicos, el fluconazol puede aumentar los niveles plasmáticos de los alcaloides de la vinca (p. Ej., Vincristina y vinblastina), dando lugar a neurotoxicidad, que es posible debido al efecto inhibidor sobre CYP3A4.
Vitamina A
En un caso notificado en un paciente que recibía terapia concomitante con ácido todo-trans-retinoico (una forma ácida de la vitamina A) y fluconazol, se desarrollaron reacciones adversas relacionadas con el sistema nervioso central en forma de pseudotumor cerebral, que desapareció tras la interrupción del tratamiento con fluconazol.Los dos fármacos pueden utilizarse en combinación, pero debe tenerse en cuenta la incidencia de reacciones adversas relacionadas con el sistema nervioso central.
Voriconazol (inhibidor de CYP2C9 y CYP3A4)
La administración concomitante de voriconazol oral (400 mg Q12h durante 1 día, luego 200 mg Q12h durante 2.5 días) y fluconazol oral (400 mg el día 1, luego 200 mg Q24h durante 4 días) a 8 varones sanos resultó en un aumento de voriconazol Cmax y AUC de una media de 57% (IC del 90%: 20%, 107%) y 79% (IC del 90%: 40%, 128%), respectivamente. No se ha definido. Qué reducciones en la dosis y / o la frecuencia de voriconazol y fluconazol podría eliminar este efecto. Si el voriconazol se usa secuencialmente después de fluconazol, se recomienda monitorear los eventos adversos asociados con voriconazol.
Zidovudina
El fluconazol aumenta la Cmax y el AUC de zidovudina en un 84% y 74%, respectivamente, debido a una disminución de aproximadamente un 45% en el aclaramiento de zidovudina oral. De manera similar, la vida media de zidovudina se prolongó en aproximadamente un 128% después de la administración concomitante con fluconazol. Los pacientes que reciben esta terapia concomitante deben ser monitoreados por la posible aparición de reacciones adversas relacionadas con zidovudina, posibilidad de una reducción en las dosis de zidovudina.
Azitromicina
Un estudio cruzado de tres brazos, aleatorizado y abierto en 18 voluntarios sanos determinó los efectos de una dosis oral única de 1200 mg de azitromicina sobre la farmacocinética de una dosis oral única de 800 mg de fluconazol, así como los efectos de fluconazol sobre la farmacocinética. de No hubo interacción farmacocinética significativa entre fluconazol y azitromicina.
Anticonceptivos orales
Se realizaron dos estudios farmacocinéticos con terapia anticonceptiva oral combinada administrada en combinación con múltiples dosis de fluconazol. No hubo efectos relevantes en los niveles de las dos hormonas de los pacientes que recibieron fluconazol 50 mg, mientras que el AUC de etinilestradiol y levonorgestrel en el grupo que tomó fluconazol 200 mg / día mostró un aumento del 40% y 24% respectivamente. de dosis múltiples de fluconazol en estas dosis no cambia la eficacia de una terapia anticonceptiva oral combinada.
04.6 Embarazo y lactancia
El embarazo
Datos de varios cientos de mujeres embarazadas tratadas con dosis estándar de fluconazol (primer trimestre, no mostraron efectos secundarios fetales. En bebés cuyas madres estaban recibiendo tratamiento con dosis altas de fluconazol (400-800 mg / día) para la coccidioidomicosis durante un período de ≥ 3 meses. , se han reportado múltiples anomalías congénitas (incluyendo braquicefalia, displasia auricular, fontanela anterior gigante, curvatura femoral y sinostosis radiohumeral) La relación entre el uso de fluconazol y estos eventos no es clara.
Los estudios en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
El fluconazol en dosis estándar y durante períodos cortos de tratamiento no debe usarse durante el embarazo a menos que sea estrictamente necesario.
El fluconazol en dosis altas y / o durante períodos de tratamiento prolongados solo debe usarse durante el embarazo para infecciones potencialmente mortales.
Hora de la comida
El fluconazol pasa a la leche materna y alcanza concentraciones por debajo de los niveles plasmáticos. Se puede continuar con la lactancia después de la administración de una dosis única estándar de fluconazol de 200 mg o menos. No se recomienda la lactancia después de un uso repetido o después de dosis altas de fluconazol.
Fertilidad
El fluconazol no tuvo ningún efecto sobre la fertilidad de ratas macho o hembra (ver sección 5.3).
04.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre los efectos de Diflucan sobre la capacidad para conducir y utilizar máquinas. Se debe advertir a los pacientes que ocasionalmente pueden producirse mareos o convulsiones (ver sección 4.8) durante el tratamiento con Diflucan, y que no deben conducir ni utilizar maquinaria si se presenta alguno de estos síntomas.
04.8 Efectos indeseables
Las reacciones adversas notificadas con más frecuencia (> 1/10) son dolor de cabeza, dolor abdominal, diarrea, náuseas, vómitos, aumento de alanina aminostransferasa, aumento de aspartato aminotransferasa, aumento de fosfatasa alcalina en sangre y erupción.
Se han observado y notificado las siguientes reacciones adversas durante el tratamiento con fluconazol, con las siguientes frecuencias: muy frecuentes (≥1 / 10); común (≥1 / 100,
Población pediátrica
El tipo y la incidencia de reacciones adversas y cambios de laboratorio observados en los ensayos clínicos pediátricos, con la excepción de la indicación de candidiasis genital, son comparables a los observados en adultos.
04.9 Sobredosis
Se han notificado casos de sobredosis con Diflucan y se han notificado alucinaciones y comportamiento paranoico concomitantes.
En caso de sobredosis accidental, puede ser necesario un tratamiento sintomático (con "terapia de apoyo adecuada y posiblemente lavado gástrico).
El fluconazol se excreta principalmente en la orina; La diuresis forzada probablemente aumenta la tasa de eliminación. Una sesión de hemodiálisis de 3 horas reduce los niveles plasmáticos en aproximadamente un 50%.
05.0 PROPIEDADES FARMACOLÓGICAS
05.1 Propiedades farmacodinámicas
Clasificación ATC
Grupo farmacoterapéutico: Antifúngicos para uso sistémico, derivados de triazol, código ATC: J02AC01.
Mecanismo de acción
El fluconazol es un antifúngico triazol. Su principal mecanismo de acción es la inhibición de la desmetilación del 14 alfa-lanosterol mediada por el citocromo P-450 fúngico, un paso esencial en la biosíntesis del ergosterol fúngico.
La acumulación de 14 alfa-metil-esteroles está relacionada con la consiguiente pérdida de ergosterol en la membrana de la célula fúngica y podría ser la base de la actividad antifúngica del fluconazol.
Era evidente que el fluconazol es más selectivo para las enzimas del citocromo P-450 fúngico que para varios sistemas enzimáticos del citocromo P-450 de mamíferos.
Se ha demostrado que 50 mg / día de fluconazol administrado durante un máximo de 28 días no altera la concentración plasmática de testosterona en hombres ni la concentración de esteroides en mujeres en edad fértil. no causa ningún efecto clínicamente significativo sobre los niveles de esteroides endógenos o la respuesta a la estimulación con ACTH en voluntarios varones sanos Los estudios de interacción con antipirina demuestran que dosis única o múltiple de 50 mg de fluconazol no altera su metabolismo.
Sensibilidad in vitro
In vitro, el fluconazol exhibe actividad antifúngica contra la mayoría de las especies de Candida clínicamente más común (incluyendo C. albicans, C. parapsilosis, C. tropicalis). Allí C. glabrata muestra una amplia gama de sensibilidad mientras que el C. krusei es resistente al fluconazol.
El fluconazol también exhibe actividad in vitro para Cryptococcus neoformans Y Cryptococcus gattoi y también hacia levaduras endémicas Dermatiditis por Blastomyces, Coccidioides immitis, Histoplasma capsulatum Y Paracoccidioides brasiliensis.
Relación farmacocinética / farmacodinámica (PK / PD)
En estudios con animales, existe una correlación entre los valores de concentración mínima inhibitoria (CMI) y la eficacia frente a micosis experimentales debido a la especie a ser Candida. En los estudios clínicos, existe una relación lineal de casi 1: 1 entre el AUC y la dosis de fluconazol. También existe una relación directa, aunque imperfecta, entre el AUC o la dosis y una respuesta clínica eficaz al tratamiento de la candidiasis oral y, en menor medida, candidemia. De manera similar, la curación es menos probable para las infecciones causadas por cepas con una CIM de fluconazol más alta.
Mecanismo (s) de resistencia
los Candida spp han desarrollado algunos mecanismos de resistencia a los antifúngicos azólicos. Se sabe que las cepas de hongos que han desarrollado uno o más de estos mecanismos de resistencia exhiben MIC elevadas al fluconazol, lo que tiene un impacto negativo en la eficacia. en vivo ya nivel clínico.
Ha habido informes de sobreinfecciones con la especie de Candida otro que C. albicans, que a menudo son inherentemente insensibles al fluconazol (p. ej. Candida krusei). En estos casos, es posible que se requiera una terapia antimicótica alternativa.
Puntos de interrupción (EUCAST)
Basado en el análisis de datos de PK / PD, sensibilidad in vitro y respuesta clínica, el EUCAST-AFST (Comité Europeo de Pruebas de Sensibilidad a los Antimicrobianos-subcomité de Pruebas de Sensibilidad a los Antifúngicos) determinó los puntos de corte para el fluconazol para la especie Candida(Documento racional de EUCAST Fluconazol -versión 2).
Estos se han dividido en puntos de corte no relacionados con especies, que se determinaron principalmente sobre la base de datos de PK / PD y son independientes de las distribuciones de CMI de especies individuales y puntos de corte relacionados con especies, para las especies más frecuentemente asociadas con infecciones en el "hombre . Los puntos de interrupción se muestran en la siguiente tabla:
S = sensible, R = resistente
A = Los puntos de corte no relacionados con especies se determinaron principalmente sobre la base de datos de PK / PD y son independientes de las distribuciones de CMI de las especies individuales. Se utilizan solo para organismos que no tienen puntos de corte específicos.
-- = Las pruebas de susceptibilidad no se recomiendan ya que la terapia con medicamentos no es la más adecuada para esta especie.
IE = No hay pruebas suficientes de que la terapia con medicamentos sea adecuada para esta especie.
05.2 Propiedades farmacocinéticas
Las propiedades farmacocinéticas del fluconazol son similares con la administración tanto intravenosa como oral.
Absorción
Cuando se administra por vía oral, el fluconazol se absorbe bien, con niveles plasmáticos (y biodisponibilidad sistémica) superiores al 90% de los niveles alcanzados después de la administración intravenosa. La absorción oral no se ve modificada por la ingesta simultánea de alimentos, los picos de concentración plasmática en ayunas se alcanzan transcurridos entre 30 y 90 minutos desde la ingesta. Las concentraciones plasmáticas son proporcionales a las dosis administradas.
90% del nivel de estado estable se alcanza después de 4 o 5 días de administración repetida una vez al día. La administración de una dosis de carga (el día 1) igual al doble de la dosis diaria normal permite que los niveles plasmáticos alcancen casi el 90% de los niveles. estado estable ya en el segundo día.
Distribución
El volumen aparente de distribución es comparable a la cantidad total de agua corporal. La unión a proteínas plasmáticas es baja (11-12%).
El fluconazol tiene una buena penetración en todos los fluidos orgánicos estudiados. Los niveles de fluconazol en la saliva y el esputo son similares a los niveles plasmáticos En pacientes con meningitis fúngica, los niveles de fluconazol en el LCR son aproximadamente el 80% de los niveles plasmáticos correspondientes.
Las concentraciones cutáneas elevadas de fluconazol, por encima de las concentraciones séricas, se alcanzan en el estrato córneo, a nivel de la epidermis y la dermis y las glándulas sudoríparas. El fluconazol se acumula en el estrato córneo. Tras el uso de una dosis de 50 mg / día durante 12 días a Se detectó una concentración de fluconazol de 73 mcg / g y 7 días después de la interrupción del tratamiento el nivel del fármaco seguía siendo igual a 5,8 mcg / g. Tras la administración de una dosis semanal de 150 mg, la concentración de fluconazol en el estrato córneo en el séptimo día de la terapia fue de 23,4 mcg / gy 7 días después de la administración de la 2ª dosis, los niveles seguían siendo iguales a 7,1 mcg / g.
Después de 4 meses de 150 mg de fluconazol una vez a la semana, la concentración de fluconazol fue de 4.05 mcg / g en uñas sanas y 1.8 mcg / g en uñas enfermas. Además, el fluconazol todavía estaba disponible en muestras de uñas 6 meses después del final de la terapia.
Biotransformación
El fluconazol se metaboliza solo en pequeña medida. De una dosis radiactiva, solo el 11% se excreta en forma modificada en la orina. El fluconazol es un inhibidor selectivo de las isoenzinas CYP2C9 y CYP3A4 (ver sección 4.5). El fluconazol también es un inhibidor de la isoenzima CYP2C19.
Excreción
La vida media de eliminación plasmática del fluconazol es de aproximadamente 30 horas La vía principal de eliminación es la renal: aproximadamente el 80% de la dosis administrada se encuentra inalterada en la orina. El aclaramiento de fluconazol es proporcional al de creatinina. No hay evidencia de metabolitos circulantes.
La larga vida media de eliminación plasmática constituye la base de la terapia de dosis única para la candidiasis vaginal, una vez al día y una vez a la semana para otras indicaciones.
Farmacocinética en insuficiencia renal
En pacientes con insuficiencia renal grave (TFG
Por tanto, es necesario reducir la dosis. El fluconazol se elimina mediante hemodiálisis y, en menor medida, mediante diálisis peritoneal. Después de tres horas de sesión de hemodiálisis, aproximadamente el 50% del fluconazol se elimina de la sangre.
Farmacocinética en niños
Los datos farmacocinéticos se evaluaron en 113 pacientes pediátricos de 5 estudios: 2 estudios de dosis única, 2 estudios de dosis múltiples y un estudio de recién nacidos prematuros. Los datos del primer estudio no se pudieron interpretar debido a cambios en la redacción durante el estudio. Los datos adicionales provienen de un estudio de uso compasivo.
Después de la administración de fluconazol en dosis de 2-8 mg / kg a niños de 9 meses a 15 años, se observó un AUC de aproximadamente 38 mcg • h / ml para dosis de 1 mg / kg. La vida media de eliminación plasmática media de fluconazol osciló entre 15 y 18 horas y el volumen de distribución después de la administración de dosis múltiples fue de aproximadamente 880 ml / kg. Se observó una vida media de eliminación plasmática más alta después de la administración única, aproximadamente 24 horas. es comparable a la vida media de eliminación plasmática de fluconazol después de una única administración de 3 mg / kg por vía intravenosa a niños de 11 días a 11 meses. El volumen de distribución en este grupo de edad fue de aproximadamente 950 ml / kg.
La experiencia con fluconazol en neonatos se limita a estudios farmacocinéticos en neonatos prematuros. Para 12 neonatos prematuros con una edad gestacional de aproximadamente 28 semanas, la edad media de la primera dosis fue de 24 horas (rango 9-36 horas) y el peso medio al nacer fue de 0,9 kg. (rango 0,75-1,10 kg). Siete pacientes completaron el protocolo; Se administraron un máximo de cinco dosis intravenosas de 6 mg / kg de fluconazol cada 72 horas. El primer día, la vida media media fue de 74 horas (rango 44-185), y luego disminuyó, en el séptimo día, a un valor promedio de 53 horas (rango 30-131), hasta alcanzar, en el decimotercer día , un valor de 47 horas (rango 27-68). El primer día el área bajo la curva (mcg.h / ml) fue 271 (rango 173-385), para luego aumentar, en el séptimo día, hasta un valor medio de 490 (rango de 292-734) y, en cambio, disminuirá, en el decimotercer día, al valor medio de 360 (rango de 167-566). El primer día, el volumen de distribución (ml / kg) fue de 1183 (rango de 1070-1470), luego aumentó con el tiempo para alcanzar un valor medio de 1184 (rango de 510-2130) en el séptimo día y 1328 ( rango de 1040-1680) en el decimotercer día.
Farmacocinética en ancianos
Se realizó un estudio farmacocinético en 22 sujetos, de 65 años de edad o más, a los que se les administró una dosis oral única de 50 mg de fluconazol. Diez de estos sujetos estaban recibiendo diuréticos al mismo tiempo.Se registró una Cmax de 1,54 mcg / ml 1,3 horas después de la dosificación. El AUC medio fue de 76,4 ± 20,3 mcg • h / ml y la vida media media fue de 46,2 horas. Estos valores de parámetros farmacocinéticos son más altos que los valores similares informados para voluntarios varones jóvenes sanos. La administración concomitante de diuréticos no alteró significativamente el AUC o la Cmáx. Además, el aclaramiento de creatinina (74 ml / min), el porcentaje de fármaco que se encuentra inalterado en la orina (0-24 horas, 22%) y las estimaciones del aclaramiento renal de fluconazol (0,124 ml / min). min / kg) para los ancianos fueron generalmente más bajos que para los voluntarios más jóvenes.
Por tanto, el comportamiento alterado del fluconazol en el organismo de los pacientes ancianos parece estar relacionado con la función renal reducida característica de este grupo de pacientes.
05.3 Datos preclínicos sobre seguridad
Los efectos en los estudios preclínicos se observaron solo con exposiciones consideradas muy superiores a los niveles máximos de exposición humana, lo que indica poca relevancia para el uso clínico.
Carcinogénesis
El fluconazol no mostró potencial carcinogénico en ratones y ratas tratados por vía oral durante 24 meses a dosis de 2.5, 5 o 10 mg / kg / día (aproximadamente 2-7 veces la dosis humana recomendada). En ratas macho tratadas con 5 y 10 mg / kg / día se encontró una mayor incidencia de adenomas hepatocelulares.
Fertilidad deteriorada
El fluconazol no afectó la fertilidad de ratas macho o hembra tratadas por vía oral con dosis diarias de 5, 10 o 20 mg / kg o dosis parenterales de 5, 25 o 75 mg / kg.
No hubo efectos en el feto a dosis de 5 o 10 mg / kg; a dosis iguales o superiores a 25 y 50 mg / kg, se observaron aumentos en las variantes anatómicas fetales (costillas supernumerarias, dilatación de la pelvis renal) y retrasos en la osificación. A dosis que van desde 80 mg / kg a 320 mg / kg c "Hubo un aumento en la embrioletalidad en ratas, y las anomalías fetales incluyeron costillas onduladas, paladar hendido y anomalías de osificación craneofacial".
El inicio del parto se retrasó ligeramente con dosis orales de 20 mg / kg y se observó distocia y prolongación del parto en algunas ratas preñadas a 20 mg / kg y 40 mg / kg por vía intravenosa. A esto le siguió un ligero aumento en el número de mortinatos y una disminución en la supervivencia neonatal en estas dosis Los efectos sobre el parto en ratas son consistentes con la propiedad reductora de estrógeno específica de la especie inducida por dosis altas de fluconazol. No se produjo ninguna alteración hormonal de este tipo en mujeres que recibían tratamiento con fluconazol (ver sección 5.1).
06.0 INFORMACIÓN FARMACÉUTICA
06.1 Excipientes
Contenido de la cápsula:
Lactosa monohidrato
Maicena
Sílice coloidal anhidra
Estearato de magnesio
Lauril Sulfato de Sodio
Contenido de las cápsulas de la cápsula:
Cápsulas de 50 mg
Gelatina
Dióxido de titanio (E171)
Azul charol V (E131)
Cápsulas de 100 mg
Gelatina
Dióxido de titanio (E171)
Eritrosina (E127)
Azul charol V (E131)
Cápsulas de 150 mg
Gelatina
Dióxido de titanio (E171)
Azul charol V (E131)
Cápsulas de 200 mg
Gelatina
Dióxido de titanio (E171)
Eritrosina (E127))
Carmín índigo (E132)
Tinta:
Laca, óxido de hierro negro, alcohol N-butílico, alcohol deshidratado, agua purificada, propilenglicol, alcohol desnaturalizado industrial, alcohol isopropílico, solución de amoniaco fuerte, hidróxido de potasio.
06.2 Incompatibilidad
Irrelevante.
06.3 Período de validez
5 años.
06.4 Precauciones especiales de conservación
No conservar por encima de 30 ° C.
06.5 Naturaleza del envase primario y contenido del envase.
Cápsulas de 50 mg y 150 mg: blíster de PVC transparente o blíster de PVC / PVDC blanco opaco y papel de aluminio.
Cápsulas de 100 mg y 200 mg: blíster de PVC transparente o blíster de PVC opaco blanco y papel de aluminio.
Cada blíster contiene 1, 2, 3, 4, 6, 7, 10, 12, 14, 20, 28, 30, 42, 50, 60, 100 o 500 cápsulas duras.
Es posible que no se comercialicen todos los tamaños de envases.
06.6 Instrucciones de uso y manipulación
Los medicamentos no utilizados y los desechos derivados de este medicamento deben eliminarse de acuerdo con las regulaciones locales.
07.0 TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Italia S.r.l.
Via Isonzo, 71-04100 Latina
08.0 NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
DIFLUCAN 50 mg cápsulas duras - AIC n. 027267018
DIFLUCAN 100 mg cápsulas duras - AIC n. 027267044
DIFLUCAN 150 mg cápsulas duras - AIC n. 027267020
DIFLUCAN 200 mg cápsulas duras - AIC n. 027267095
09.0 FECHA DE LA PRIMERA AUTORIZACIÓN O RENOVACIÓN DE LA AUTORIZACIÓN
DIFLUCAN 50 mg cápsulas duras: 2 de mayo de 1989/31 de mayo de 2010
DIFLUCAN 100 mg cápsulas duras: 28 de mayo de 1992/31 de mayo de 2010
DIFLUCAN 150 mg cápsulas duras: 2 de mayo de 1989/31 de mayo de 2010
DIFLUCAN 200 mg cápsulas duras: 29 de julio de 1999/31 de mayo de 2010
10.0 FECHA DE REVISIÓN DEL TEXTO
2 de septiembre de 2011