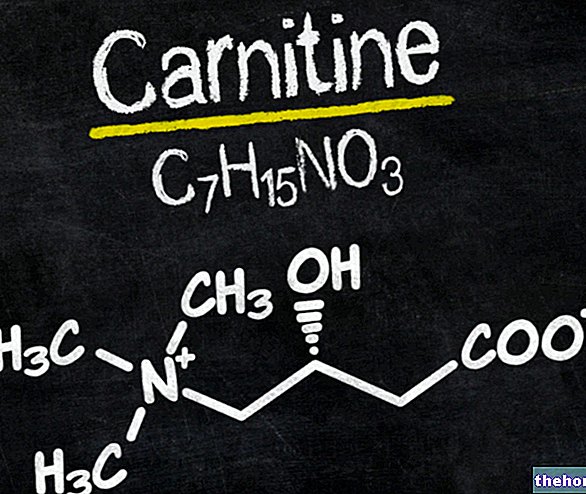
Ingredientes activos: ácido micofenólico (micofenolato de sodio)
Myfortic 180 mg comprimidos gastrorresistentes
Los prospectos de Myfortic están disponibles para los siguientes tamaños de envase:- Myfortic 180 mg comprimidos gastrorresistentes
- Myfortic 360 mg comprimidos gastrorresistentes
Indicaciones ¿Por qué se usa Myfortic? ¿Para qué sirve?
Myfortic contiene una sustancia llamada ácido micofenólico. Pertenece a un grupo de medicamentos llamados inmunosupresores.
Myfortic se utiliza para evitar que el sistema inmunológico rechace un riñón trasplantado. Se utiliza en combinación con otros medicamentos que contienen ciclosporina y corticosteroides.
Contraindicaciones Cuándo no se debe usar Myfortic
El micofenolato causa defectos de nacimiento y abortos espontáneos. Si es una mujer en edad fértil, debe proporcionar una prueba de embarazo negativa antes de iniciar el tratamiento y debe seguir los consejos sobre anticoncepción proporcionados por su médico.
Su médico hablará con usted y le dará información por escrito, especialmente sobre los efectos del micofenolato en el feto. Lea la información detenidamente y siga las instrucciones.
Si no comprende completamente las instrucciones, pídale a su médico que se las explique nuevamente antes de tomar micofenolato. Puede encontrar más información en esta sección bajo "Advertencias y precauciones" y "Embarazo y lactancia".
No tome Myfortic:
- si es alérgico (hipersensible) al ácido micofenólico, al micofenolato de sodio, al micofenolato de mofetilo oa cualquiera de los demás componentes de este medicamento
- si es una mujer en edad fértil (que puede quedar embarazada) y no ha proporcionado una prueba de embarazo negativa antes de la primera prescripción, ya que el micofenolato causa defectos de nacimiento y aborto espontáneo
- si está embarazada o tiene intención de quedarse embarazada o cree que puede estarlo
- si no está utilizando un método anticonceptivo eficaz (ver Anticoncepción en mujeres y hombres)
- si está amamantando (ver también "Embarazo y lactancia").
Si este es su caso, informe a su médico sin tomar Myfortic.
Precauciones de uso Lo que necesita saber antes de tomar Myfortic
Consulte a su médico o farmacéutico antes de tomar Myfortic:
- si tiene o ha tenido alguna vez trastornos digestivos graves, como úlcera de estómago.
- si tiene una deficiencia hereditaria rara de la enzima hipoxantina guanina fosforribosil transferasa (HGPRT), como el síndrome de Lesch-Nyhan y el síndrome de Kelley-Seegmille.
También se le debe informar que:
- Myfortic reduce el nivel de protección de la epidermis del sol. Esto aumenta el riesgo de cáncer de piel. Debe limitar la exposición al sol y a los rayos ultravioleta (UV) protegiendo al máximo las zonas expuestas y aplicando regularmente bloqueador solar de alta protección. . Pídale consejo a su médico sobre cómo protegerse del sol.
- Si ya ha tenido hepatitis B o C, Myfortic puede aumentar el riesgo de estas enfermedades haciendo que vuelvan a aparecer. Su médico puede realizar análisis de sangre y comprobar los síntomas de estas enfermedades. Si tiene algún síntoma (ojos y piel amarillos, náuseas, pérdida de apetito, orina oscura) debe informar a su médico inmediatamente.
- Si tiene tos persistente o dificultad para respirar, especialmente cuando toma otros inmunosupresores, debe informar a su médico de inmediato.
- Su médico puede pedirle que controle los niveles de anticuerpos en su sangre durante el tratamiento con Myfortc, especialmente cuando las infecciones reaparecen, especialmente si también está siendo tratado con otros inmunosupresores, y le informará si puede continuar el tratamiento con Myfortic.
- Si tiene algún signo de infección (como fiebre o dolor de garganta) o si experimenta algún hematoma o sangrado inesperado, debe informar a su médico de inmediato.
- Su médico puede pedirle que controle sus valores de glóbulos blancos durante el tratamiento con Myfortic y le informará si puede continuar el tratamiento con Myfortic.
- El principio activo, el ácido micofenólico, es diferente al de otros medicamentos con un nombre similar, como micofenolato de mofetilo. No debe cambiar de medicamento a menos que su médico se lo indique.
- El uso de Myfortic durante el embarazo puede ser perjudicial para el feto (ver también "Embarazo y lactancia") y puede aumentar el riesgo de pérdida del embarazo (aborto espontáneo).
Interacciones ¿Qué medicamentos o alimentos pueden cambiar el efecto de Myfortic?
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tomar cualquier otro medicamento, incluso los adquiridos sin receta. En particular, debe informar a su médico si está tomando alguno de los siguientes medicamentos:
- otros medicamentos inmunosupresores como azatioprina o tacrolimus.
- medicamentos utilizados para tratar los niveles elevados de colesterol en sangre, como la colestiramina.
- carbón activado utilizado para tratar trastornos digestivos como diarrea, malestar estomacal e hinchazón.
- antiácidos que contienen magnesio y aluminio.
- medicamentos utilizados para tratar infecciones virales como aciclovir o ganciclovir.
También debe informar a su médico si tiene la intención de recibir alguna vacuna.
No debe donar sangre durante el tratamiento con Myfortic y durante al menos 6 semanas después de interrumpir el tratamiento. Los hombres no deben donar esperma durante el tratamiento con Myfortic y durante al menos 90 días después de interrumpir el tratamiento.
Myfortic se puede tomar con o sin alimentos. Debe elegir si tomar los comprimidos con o sin alimentos y luego seguir tomándolos de la misma forma todos los días. De esta manera, es seguro absorber la misma cantidad de medicamento todos los días.
Advertencias Es importante saber que:
Personas mayores
Las personas de edad avanzada (mayores de 65 años) pueden tomar Myfortic sin necesidad de ajustar la dosis habitual recomendada.
Población pediátrica y adolescente
Debido a la falta de datos, no se recomienda el uso de Myfortic en niños y adolescentes.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. Su médico le hablará sobre los riesgos de quedar embarazada y sobre las terapias alternativas que puede tomar para prevenir el rechazo del órgano trasplantado si:
- planear un embarazo.
- ha perdido o cree que ha perdido un período o nota un sangrado menstrual inusual o sospecha que está embarazada.
- tener relaciones sexuales sin utilizar un método anticonceptivo eficaz.
Si queda embarazada mientras toma micofenolato, debe informar a su médico de inmediato. Sin embargo, continúe tomando micofenolato hasta que haya consultado a su médico.
El embarazo
El micofenolato causa una frecuencia muy alta de abortos espontáneos (50%) y defectos de nacimiento graves (23-27%) en el feto. Los defectos de nacimiento que se han informado incluyen anomalías en los oídos, ojos, cara (labio leporino / paladar), desarrollo de los dedos, corazón, esófago (el tracto que conecta la garganta con el estómago), riñones y sistema nervioso (por por ejemplo, espina bífida (donde los huesos de la columna no están desarrollados adecuadamente) Uno o más de estos pueden afectar a su bebé.
Si es una mujer en edad fértil, debe proporcionar una prueba de embarazo negativa antes de iniciar el tratamiento y debe seguir los consejos sobre anticoncepción proporcionados por su médico. Su médico puede solicitar más de una prueba para asegurarse de que no esté embarazada antes de comenzar el tratamiento.
Hora de la comida
No tome Myfortic si está amamantando. Esto se debe a que pequeñas cantidades del medicamento pueden pasar a la leche materna.
Anticoncepción en mujeres que toman Myfortic
Si es una mujer en edad fértil, siempre debe utilizar dos métodos anticonceptivos eficaces con Myfortic. Esto incluye:
- Antes de iniciar el tratamiento con Myfortic
- Durante todo el período de tratamiento con Myfortic
- Durante 6 semanas después de interrumpir el tratamiento con Myfortic.
Hable con su médico sobre el método anticonceptivo más adecuado para usted. Esto dependerá de su situación personal. Comuníquese con su médico lo antes posible si cree que el método anticonceptivo puede no ser efectivo y si ha olvidado tomar la píldora anticonceptiva.
Si se encuentra en alguna de las siguientes situaciones, puede considerarse una mujer infértil:
- Es posmenopáusica, es decir, tiene al menos 50 años y su última menstruación ocurrió hace más de un año (si su período se interrumpió porque recibió tratamiento contra el cáncer, todavía existe la posibilidad de que pueda permanecer embarazada).
- Le extirparon quirúrgicamente las trompas de Falopio y ambos ovarios (salpingoovariectomía bilateral)
- Su útero fue extirpado quirúrgicamente (histerectomía)
- Sus ovarios ya no funcionan (insuficiencia ovárica temprana confirmada por un ginecólogo especialista)
- Ella nació con una de las siguientes condiciones raras que hacen imposible el embarazo: el genotipo XY, el síndrome de Turner o la agenesia uterina.
- Es una "niña o una" adolescente que aún no ha tenido su primer período.
Anticoncepción en hombres que toman Myfortic
Siempre debe usar un condón durante el tratamiento y durante al menos 90 días después de suspender Myfortic.
Si planea tener un bebé, su médico le informará sobre los riesgos y los tratamientos alternativos que puede tomar para prevenir el rechazo del órgano trasplantado.
Conducción y uso de máquinas
Myfortic no parece afectar a la capacidad para conducir o utilizar máquinas.
Myfortic contiene lactosa
Si su médico le ha dicho que padece "intolerancia a algunos azúcares (como lactosa, galactosa o glucosa), consulte con él antes de tomar Myfortic".
Dosis, método y momento de administración Cómo usar Myfortic: Posología
Tome siempre Myfortic exactamente como le haya indicado su médico. Myfortic solo le será recetado por médicos con experiencia en el tratamiento de pacientes trasplantados. Si no está seguro, consulte a su médico o farmacéutico.
Que dosis tomar
La dosis diaria recomendada de Myfortic es de 1440 mg (8 comprimidos de Myfortic 180 mg). Se toman en 2 dosis separadas de 720 mg cada una (4 comprimidos de Myfortic de 180 mg). Tome los comprimidos por la mañana y por la noche.
La primera dosis de 720 mg se le administrará dentro de las 72 horas posteriores al trasplante.
Si tiene problemas graves de riñón
La dosis diaria no debe exceder los 1440 mg (8 comprimidos de Myfortic 180 mg).
Tomando Myfortic
Trague los comprimidos enteros con un vaso de agua.
Las tabletas no deben romperse ni triturarse.
No tome tabletas rotas o partidas
El tratamiento continuará mientras se necesite inmunosupresión para evitar el rechazo del órgano trasplantado.
Si olvidó tomar Myfortic
Si olvidó tomar Myfortic, tómelo tan pronto como se acuerde, a menos que sea casi la hora de su próxima dosis. Luego, tome su próxima dosis cuando esté programado para tomarla. Pídele consejos a tu doctor. No tome una dosis doble para compensar las dosis olvidadas.
Si deja de tomar Myfortic
No deje de tomar Myfortic a menos que se lo indique su médico. La suspensión del tratamiento con Myfortic puede aumentar el riesgo de rechazo de un riñón trasplantado.
Si tiene más preguntas sobre el uso de este medicamento, consulte a su médico o farmacéutico.
Sobredosis Qué hacer si ha tomado una sobredosis de Myfortic
Si ha tomado más Myfortic del que le indicaron o si otra persona ha tomado sus comprimidos, póngase en contacto con su médico y acuda a un hospital inmediatamente. Es posible que se requiera tratamiento médico. Lleve los comprimidos y enséñelos a su médico o al personal del hospital. Si se han quedado sin comprimidos, lleve consigo el envase vacío.
Efectos secundarios ¿Cuáles son los efectos secundarios de Myfortic?
Al igual que todos los medicamentos, Myfortic puede producir efectos adversos, aunque no todas las personas los sufran. Los pacientes de edad avanzada pueden experimentar más efectos secundarios debido a una defensa inmunológica reducida.
Los inmunosupresores, incluido Myfortic, reducen los mecanismos de defensa de su cuerpo para evitar que rechace su órgano trasplantado. Como resultado, su cuerpo no podrá defenderse de las infecciones como lo haría en condiciones normales. Por lo tanto, si está tomando Myfortic, puede contraer más infecciones de lo habitual, como infecciones del cerebro, piel, boca, estómago e intestinos, pulmones y tracto urinario.
Su médico realizará análisis de sangre periódicos para comprobar si hay cambios en el número de células sanguíneas o en los niveles de sustancias transportadas en la sangre, como azúcar, grasas y colesterol.
Algunos efectos colaterales pueden ser serios:
- signos de infección que incluyen fiebre, escalofríos, sudoración, sensación de cansancio, sueño o falta de energía. Si está tomando Myfortic, puede tener infecciones virales, bacterianas y micóticas con más frecuencia de lo habitual. Estas infecciones pueden afectar a diferentes partes del cuerpo, pero más comúnmente a los riñones, la vejiga y las vías respiratorias superiores y / o inferiores.
- vómitos hemorrágicos, heces oscuras o con sangre, úlcera de estómago o intestinal.
- hinchazón de las glándulas, proliferación de nuevas formaciones cutáneas, aumento del volumen de formaciones existentes o alteraciones de una formación ya existente. Como puede ocurrir en pacientes tratados con inmunosupresores, un número muy reducido de pacientes que toman Myfortic han desarrollado cáncer de piel o de ganglios linfáticos.
Si ha experimentado alguno de los efectos secundarios anteriores después de tomar Myfortic, comuníquese con su médico de inmediato.
Otros efectos secundarios pueden incluir:
Muy frecuentes (afectan a más de 1 de cada 10 pacientes)
- niveles bajos de glóbulos blancos.
- niveles bajos de calcio en sangre (hipocalcemia)
- niveles bajos de potasio en sangre (hipopotasemia)
- niveles elevados de ácido úrico en sangre (hiperuricemia)
- presión arterial alta (hipertensión)
- ansiedad
- Diarrea
- dolor articular (artralgia)
Frecuentes (afectan a menos de 1 de cada 10 pacientes)
- niveles bajos de glóbulos rojos que pueden causar cansancio, dificultad para respirar y palidez (anemia)
- niveles bajos de plaquetas en la sangre que pueden causar hemorragias y hematomas inesperados (trombocitopenia)
- niveles elevados de potasio en sangre (hiperpotasemia)
- niveles bajos de magnesio en sangre (hipomagnesemia)
- mareo
- dolor de cabeza
- tos
- presión arterial baja (hipotensión)
- dificultad para respirar (disnea)
- dolor en el abdomen o estómago, inflamación de la pared del estómago, distensión abdominal, estreñimiento, dispepsia, flatulencia, heces blandas, náuseas, vómitos
- fatiga, fiebre
- resultados anormales de las pruebas de función hepática y renal
- infecciones respiratorias
- acné
- debilidad (astenia)
- dolor muscular (mialgia)
- hinchazón de manos, tobillos o pies (edema periférico)
- picar
Poco frecuentes (afectan a menos de 1 de cada 100 pacientes)
- latidos cardíacos rápidos (taquicardia) o irregulares (extrasístoles ventriculares), líquido en los pulmones (edema pulmonar)
- formación de piel similar a un quiste que contiene líquido (linfocele)
- temblor, dificultad para dormir
- enrojecimiento e hinchazón de los ojos (conjuntivitis), visión borrosa
- sibilancias
- eructos, dificultad para respirar, obstrucción intestinal (íleo), ulceración de los labios, ardor de estómago, decoloración de la lengua, sequedad de boca, inflamación de las encías, inflamación del páncreas que causa dolor severo en la parte superior del estómago (pancreatitis), obstrucción de las glándulas salivales, inflamación de la pared interna del abdomen (peritonitis)
- infección de los huesos, la sangre y la piel
- sangre en la orina, daño renal, dolor y dificultad para orinar
- caída del cabello, hematomas
- inflamación de las articulaciones (artritis), dolor de espalda, calambres musculares
- pérdida de apetito, aumento de los niveles de lípidos (hiperlipidemia), azúcar (diabetes), colesterol (hipercolesterolemia) o disminución de los niveles de fosfato en sangre (hipofosfatemia)
- signos de gripe (como cansancio, escalofríos, dolor de garganta, dolor articular o muscular), hinchazón de tobillos y pies, dolor, rigidez, sed o debilidad
- sueños anormales, sensación de decepción
- incapacidad para tener o mantener una erección
- tos, dificultad para respirar, dolor al respirar (posibles síntomas de enfermedad pulmonar intersticial).
Frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles)
- sarpullido
- fiebre, dolor de garganta, infecciones frecuentes (posibles síntomas de falta de glóbulos blancos) (agranulocitosis)
Otros efectos adversos notificados con medicamentos similares a Myfortic
Se han notificado efectos adversos adicionales con el grupo de medicamentos al que pertenece Myfortic: inflamación del colon (intestino grueso), inflamación de las paredes del estómago causada por citomegalovirus, formación de una lesión en la pared intestinal que causa dolor severo en el abdomen con la posibilidad de hemorragia, úlcera de estómago o duodenal, niveles bajos de glóbulos blancos específicamente o de todos los glóbulos, infecciones graves como inflamación del corazón y las válvulas y membranas del corazón que recubren el cerebro y la médula espinal, dificultad para respirar, tos que puede ser causada por bronquiectasias (una afección en la que las vías respiratorias de los pulmones se dilatan anormalmente) y otras infecciones bacterianas menos comunes que suelen causar problemas pulmonares graves (tuberculosis e infecciones micobacterianas atípicas). Comuníquese con su médico si tiene tos persistente o dificultad para respirar. .
Notificación de efectos secundarios
Si experimenta cualquier efecto adverso, consulte a su médico o farmacéutico, incluido cualquier posible efecto adverso no mencionado en este prospecto. También puede informar los efectos secundarios directamente a través del sistema nacional de notificación en www.agenziafarmaco.it/it/responsabili Al notificar los efectos secundarios, puede ayudar a proporcionar más información sobre la seguridad de este medicamento.
Caducidad y retención
Mantenga este medicamento fuera de la vista y del alcance de los niños.
No utilice Myfortic después de la fecha de caducidad que aparece en la caja. La fecha de caducidad se refiere al último día del mes.
No conservar por encima de 30 ° C.
Guarde Myfortic en el paquete original para protegerlo de la humedad. No use Myfortic si nota que el paquete está dañado o muestra signos de alteración.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita, ya que esto ayudará a proteger el medio ambiente.
Otra información
Qué contiene Myfortic
- El ingrediente activo es ácido micofenólico (como micofenolato de sodio) Cada comprimido de Myfortic contiene 180 mg de ácido micofenólico.
- Los excipientes son:
- Tableta central: almidón de maíz, povidona, crospovidona, lactosa anhidra, sílice coloidal anhidra, estearato de magnesio.
- Recubrimiento del comprimido: ftalato de hipromelosa, dióxido de titanio (E 171), óxido de hierro amarillo (E 172), índigo carmín (E 132).
Aspecto de Myfortic y contenido del envase
Los comprimidos gastrorresistentes de Myfortic 180 mg son de color verde amarillento, recubiertos con película, redondos y con una "C" grabada en una cara. Los comprimidos gastrorresistentes de Myfortic 180 mg están disponibles en blísteres que contienen 20, 50, 100, 120 o 250 comprimidos.
Es posible que no se comercialicen todos los tamaños de envases.
Prospecto fuente: AIFA (Agencia Italiana de Medicamentos). Contenido publicado en enero de 2016. Es posible que la información presente no esté actualizada.
Para tener acceso a la versión más actualizada, es recomendable acceder al sitio web de la AIFA (Agencia Italiana de Medicamentos). Descargo de responsabilidad e información útil.
01.0 NOMBRE DEL MEDICAMENTO
COMPRIMIDOS MYFORTIC 180 MG RESISTENTES A LOS ALIMENTOS
02.0 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido gastrorresistente contiene 180 mg de ácido micofenólico (como micofenolato de sodio).
Excipientes:
Lactosa anhidra: 45 mg por comprimido.
Para consultar la lista completa de excipientes, ver sección 6.1.
03.0 FORMA FARMACÉUTICA
Tableta gastrorresistente.
Comprimidos recubiertos con película de forma redonda, de color verde amarillento, con las esquinas biseladas grabadas con una "C" en una cara.
04.0 INFORMACIÓN CLÍNICA
04.1 Indicaciones terapéuticas
Myfortic está indicado en combinación con ciclosporina y corticosteroides, para la profilaxis del rechazo agudo, en pacientes adultos que reciben un alotrasplante renal.
04.2 Posología y forma de administración
El tratamiento con Myfortic debe ser iniciado y continuado por médicos de trasplantes debidamente calificados.
La dosis recomendada es de 720 mg dos veces al día (dosis diaria de 1440 mg). En términos de contenido de ácido micofenólico (MPA), esta dosis de micofenolato de sodio corresponde a 1 g de micofenolato de mofetilo dos veces al día (dosis diaria de 2 g).
Para obtener más información sobre la combinación de dosis terapéuticas de micofenolato de sodio y micofenolato de mofetilo, ver secciones 4.4 y 5.2.
En pacientes trasplantados de-novo La administración de Myfortic debe iniciarse dentro de las 72 horas posteriores a la cirugía de trasplante.
Myfortic puede tomarse con o entre comidas. Los pacientes pueden elegir uno de los dos modos de administración, pero deberán conservarlo durante todo el período de toma del medicamento (ver sección 5.2).
Los comprimidos de Myfortic no deben triturarse para mantener intacto el recubrimiento entérico. En los casos en que sea necesario triturar las tabletas de Myfortic, evitar la inhalación del polvo o el contacto directo del polvo con la piel o las membranas mucosas. Si ocurre el contacto, lávese bien con agua y jabón; enjuague los ojos solo con agua natural. efectos del micofenolato.
Población pediátrica y adolescente
No hay datos suficientes disponibles para documentar la eficacia y seguridad de Myfortic en niños y adolescentes.Se dispone de datos farmacocinéticos limitados en pacientes pediátricos con trasplante renal (ver sección 5.2).
Personas mayores
La dosis recomendada en pacientes de edad avanzada es de 720 mg dos veces al día.
Pacientes con insuficiencia renal
No se requiere ajuste de dosis en pacientes con función renal retrasada después del trasplante (ver sección 5.2).
Sin embargo, los pacientes con insuficiencia renal grave (tasa de filtración glomerular
Pacientes con insuficiencia hepática
No se requieren ajustes de dosis en pacientes con trasplante de riñón e insuficiencia hepática grave.
Tratamiento durante episodios de rechazo
No se han observado cambios en la farmacocinética del ácido micofenólico (MPA) durante los episodios de rechazo después de un trasplante renal; por lo tanto, no es necesario ajustar la dosis ni interrumpir el tratamiento con Myfortic.
04.3 Contraindicaciones
Myfortic no debe usarse en pacientes con hipersensibilidad al micofenolato de sodio, ácido micofenólico, micofenolato de mofetilo o cualquiera de los excipientes (ver sección 6.1).
Myfortic no debe administrarse a mujeres en período de lactancia ni a mujeres en edad fértil que no utilicen métodos anticonceptivos altamente eficaces y no debe iniciarse sin una prueba de embarazo para descartar el uso involuntario del medicamento durante el embarazo (ver sección 4.6). ).
Myfortic no debe utilizarse durante el embarazo a menos que exista un tratamiento alternativo adecuado para prevenir el rechazo de órganos (ver sección 4.6).
Myfortic no debe administrarse a mujeres en período de lactancia (ver sección 4.6).
04.4 Advertencias especiales y precauciones de uso apropiadas
Los pacientes que reciben terapia inmunosupresora basada en una combinación de medicamentos, incluido Myfortic, tienen un mayor riesgo de desarrollar linfomas u otras neoplasias malignas, especialmente de la piel (ver sección 4.8). El riesgo parece estar relacionado con la intensidad y duración del tratamiento inmunosupresor más que con el uso de un producto específico. Como advertencia general, para reducir el riesgo de cáncer de piel, es necesario limitar la exposición a la luz solar y los rayos UV mediante el uso de ropa protectora y cremas solares con un factor de protección alto.
Se debe instruir a los pacientes tratados con Myfortic sobre la necesidad de informar de inmediato cualquier signo de infección o la presencia de hematomas, hemorragias o cualquier otra manifestación inesperada de depresión de la médula ósea.
Los pacientes tratados con inmunosupresores, incluido Myfortic, tienen un mayor riesgo de infecciones oportunistas (bacterianas, fúngicas, virales y protozoarias), infecciones mortales y sepsis (ver sección 4.8). Las infecciones oportunistas incluyen la nefropatía asociada al virus BK y la leucoencefalopatía multifocal progresiva (LMP) asociada al virus JC. Estas infecciones a menudo se deben a una alta carga inmunosupresora total y pueden conducir a afecciones graves o fatales que los médicos deben considerar al hacer un diagnóstico diferencial en pacientes inmunosuprimidos con empeoramiento de la función renal o síntomas neurológicos.
Se han notificado casos de hipogammaglobulinemia en asociación con infecciones recurrentes en pacientes que recibieron Myfortic en combinación con otros inmunosupresores. En algunos de estos casos, el cambio de los derivados del MPA a un inmunosupresor alternativo dio como resultado que los niveles de IgG en suero volvieran a la normalidad. En pacientes tratados con Myfortic que desarrollen infecciones recurrentes, deben medirse las inmunoglobulinas séricas. En casos de hipogammaglobulinemia persistente clínicamente relevante, se debe considerar una intervención clínica adecuada teniendo en cuenta los potentes efectos citostáticos del ácido micofenólico sobre los linfocitos T y B.
Se han notificado casos de bronquiectasias en pacientes tratados con Myfortic en combinación con otros inmunosupresores. En algunos de estos casos, el cambio de los derivados del MPA a otro inmunosupresor mejoró los síntomas respiratorios. El riesgo de bronquiectasias puede estar relacionado con hipogammaglobulinemia o un efecto directo sobre el pulmón. También se han notificado casos aislados de enfermedad pulmonar intersticial (ver sección 4.8). Se recomienda que los pacientes que desarrollen síntomas respiratorios persistentes, como tos y disnea, se estudian para detectar cualquier evidencia de enfermedad pulmonar intersticial subyacente.
Se ha notificado la reactivación de la hepatitis B (VHB) o hepatitis C (VHC) en pacientes tratados con inmunosupresores, incluidos los derivados del ácido micofenólico micofórico (MPA) y el micofenolato mofetilo (MMF). Se recomienda la monitorización de los pacientes infectados para detectar signos clínicos y de laboratorio de infección activa por VHB o VHC.
Se han notificado casos de aplasia pura de glóbulos rojos (PRCA) en pacientes tratados con derivados del ácido micofenólico (que incluyen micofenolato de mofetilo y micofenolato de sodio) en combinación con otros fármacos inmunosupresores. Se desconoce la PRCA inducida por micofenol. La AEP puede resolverse con la reducción de la dosis o la interrupción del tratamiento Los cambios de tratamiento con Myfortic en pacientes trasplantados solo deben realizarse bajo la supervisión clínica adecuada para minimizar el riesgo de rechazo (ver sección 4.8).
Los pacientes tratados con Myfortic deben ser controlados para detectar trastornos sanguíneos (por ejemplo, neutropenia o anemia, ver sección 4.8), que pueden estar relacionados con el ácido micofenólico en sí, medicamentos concomitantes, infecciones virales o combinaciones de estas causas. Por lo tanto, los pacientes tratados con Myfortic deben tener un hemograma completo cada semana durante el primer mes de tratamiento, dos veces al mes durante el segundo y tercer mes y luego mensualmente hasta el final del primer año de tratamiento. En caso de trastornos sanguíneos (p. Ej., Neutropenia con recuento absoluto de neutrófilos
Se debe advertir a los pacientes que las vacunas pueden ser menos efectivas durante el tratamiento con ácido micofenólico, mientras que se deben evitar las vacunaciones con vacunas vivas atenuadas (ver sección 4.5). La vacunación contra la influenza aún puede ser útil; los médicos deben consultar las pautas nacionales de vacunación contra la influenza.
Dado que los derivados del ácido micofenólico se han asociado con una mayor incidencia de reacciones adversas que afectan al sistema digestivo, incluidos casos poco frecuentes de úlcera gastrointestinal, hemorragia y perforación, Myfortic debe administrarse con precaución en pacientes con enfermedad grave en la fase activa del sistema digestivo. .
Se recomienda no administrar Myfortic al mismo tiempo que azatioprina, ya que no se ha estudiado la coadministración de estos medicamentos.
Debido al diferente perfil farmacocinético, el ácido micofenólico (como sal sódica) y el micofenolato de mofetilo no deben intercambiarse ni sustituirse de forma indiscriminada. Myfortic se administró en combinación con ciclosporina y corticoesteroides.
La experiencia de la administración de fármacos con terapias de inducción como la globulina anti-linfocitos T o basiliximab es limitada No se ha estudiado la eficacia y seguridad de Myfortic en combinación con otros agentes inmunosupresores (por ejemplo, tacrolimus).
Myfortic contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, deficiencia de Lapp-Lactasa o problemas de absorción de glucosa-galactosa no deben tomar este medicamento.
La administración de Myfortic de forma concomitante con fármacos que interfieren con la circulación enterohepática, como la colestiramina y el carbón activado, puede provocar una exposición sistémica al MPA por debajo de los niveles terapéuticos y, en consecuencia, una eficacia reducida.
Myfortic es un inhibidor de la enzima inosina monofosfato deshidrogenasa (IMPDH), por lo que no debe utilizarse en pacientes con enfermedades hereditarias raras que impliquen una deficiencia de la enzima hipoxantina-guanina-fosforribosiltransferasa (HGPRT), como el síndrome de Síndrome de Lesch-Nyhan y Kelley-Seegmiller.
La terapia con Myfortic no debe iniciarse antes de obtener una prueba de embarazo negativa.Se debe utilizar un método anticonceptivo eficaz antes de iniciar el tratamiento con Myfortic, durante el tratamiento y durante seis semanas después de la interrupción (ver sección 4.6).
Efectos teratogénicos
El micofenolato es un potente teratógeno humano Se han notificado abortos espontáneos (tasa 45-49%) y malformaciones congénitas (tasa estimada 23-27%) después de la exposición al micofenolato mofetilo durante el embarazo. Por tanto, Myfortic está contraindicado durante el embarazo a menos que existan tratamientos alternativos adecuados para prevenir el rechazo del trasplante. Los pacientes masculinos y femeninos en edad fértil deben ser informados de los riesgos y seguir las recomendaciones dadas en la sección 4.6 (por ejemplo, métodos anticonceptivos, pruebas de embarazo) antes, durante y después del tratamiento con Myfortic. Los médicos deben asegurarse de que tanto las mujeres como los hombres que reciben tratamiento con micofenolato comprendan el riesgo de daño al feto, así como la necesidad de un método anticonceptivo eficaz, y deben buscar atención médica inmediata si existe la posibilidad de un embarazo.
Anticoncepción (ver sección 4.6)
Debido al potencial genotóxico y teratogénico de Myfortic, las mujeres en edad fértil deben utilizar dos métodos anticonceptivos fiables al mismo tiempo antes de iniciar el tratamiento con Myfortic, durante este y durante las seis semanas posteriores a la interrupción del tratamiento; a menos que se utilice el método anticonceptivo elegido. abstinencia.
Se recomienda a los hombres sexualmente activos que utilicen condones durante el tratamiento y durante al menos 90 días después de suspender el tratamiento. El uso de condones es válido tanto para hombres fértiles como para aquellos que se han sometido a una vasectomía, ya que los riesgos asociados con el paso del líquido seminal también se aplican a los hombres que se han sometido a una vasectomía. Además, se recomienda el uso de las mujeres compañeras de los pacientes tratados con Myfortic. anticoncepción altamente eficaz durante el tratamiento y durante un total de 90 días después de la última dosis de Myfortic.
Materiales educativos
Para ayudar a los pacientes a evitar la exposición fetal al micofenolato y proporcionar información adicional importante sobre seguridad, el titular de la autorización de comercialización proporcionará materiales educativos a los profesionales sanitarios. Los materiales educativos reforzarán las advertencias sobre la teratogenicidad del micofenolato y proporcionarán consejos sobre anticoncepción antes de iniciar la terapia y orientación sobre la necesidad de pruebas de embarazo. El médico debe proporcionar información completa para el paciente sobre el riesgo teratogénico y los métodos de prevención del embarazo a las mujeres en edad fértil y, cuando sea relevante, a los pacientes masculinos.
Precauciones adicionales
Los pacientes no deben donar sangre durante el tratamiento o durante al menos 6 semanas después de suspender el micofenolato. Los hombres no deben donar esperma durante el tratamiento o durante 90 días después de suspender el micofenolato.
04.5 Interacciones con otros medicamentos y otras formas de interacción
Se han notificado las siguientes interacciones entre el ácido micofenólico y otros medicamentos:
Aciclovir y ganciclovir
No se ha estudiado el potencial de mielosupresión en pacientes que toman Myfortic en combinación con aciclovir o ganciclovir. Si Myfortic se administra en combinación con aciclovir / ganciclovir, puede esperarse un aumento de los niveles de MPAG (metabolito glucuronato del ácido micofenólico) y aciclovir / ganciclovir, posiblemente debido a la competencia por el mecanismo de secreción tubular.Los cambios en la farmacocinética de MPAG son de relevancia clínica en pacientes con función renal adecuada En presencia de insuficiencia renal, existe la posibilidad de un aumento de las concentraciones plasmáticas de MPAG y aciclovir / ganciclovir; en este caso, los pacientes deben ser monitoreados cuidadosamente y seguir las recomendaciones de dosificación para aciclovir / ganciclovir.
Gastroprotectores:
Antiácidos a base de magnesio y aluminio:
Se observó una disminución en el AUC y Cmax del ácido micofenólico de aproximadamente el 37% y el 25% respectivamente cuando Myfortic se administra en combinación con una dosis única de antiácido de magnesio y aluminio. Los antiácidos de magnesio y aluminio se pueden usar ocasionalmente para tratar la dispepsia ocasional. Sin embargo, no se recomienda el uso crónico diario de antiácidos de magnesio-aluminio en combinación con Myfortic debido a su potencial para disminuir la exposición al ácido micofenólico y, en consecuencia, reducir su eficacia.
Inhibidores de la bomba de protones:
En voluntarios sanos, no se observaron cambios en la farmacocinética del MPA después de la administración concomitante de Myfortic y pantoprazol a una dosis de 40 mg dos veces al día durante los cuatro días anteriores. No se dispone de datos sobre otros inhibidores de la bomba de protones administrados en dosis altas.
Anticonceptivos orales
Los estudios de interacción realizados con MMF (micofenolato de mofetilo) y anticonceptivos orales no han mostrado interacciones entre estos fármacos. Según el perfil metabólico del MPA, no se prevén interacciones entre Myfortic y los anticonceptivos orales.
Colestiramina y fármacos que se unen a los ácidos biliares
Se debe prestar atención al uso concomitante de medicamentos o terapias que pueden unirse a los ácidos biliares, como los secuestrantes de ácidos biliares o el carbón activado oral, debido a su potencial para disminuir la exposición al MPA y por lo tanto reducir la "eficacia de Myfortic".
Ciclosporina
La farmacocinética de ciclosporina, estudiada en pacientes con trasplante renal estable, no se vio afectada por la administración en estado estacionario de la dosis de Myfortic. Por el contrario, se sabe que la administración de ciclosporina concomitantemente con micofenolato de mofetilo reduce la exposición al ácido micofenólico. Por lo tanto, se cree que la ciclosporina, administrada con Myfortic, puede disminuir de manera similar las concentraciones sanguíneas de ácido micofenólico (aproximadamente un 20%, según los datos obtenidos con micofenolato de mofetilo), pero se desconoce el alcance exacto de esta disminución, ya que se desconoce esta interacción. sido estudiado. Sin embargo, como todos los estudios de eficacia se realizaron en combinación con ciclosporina, esta interacción no cambia la dosis recomendada de Myfortic. Si se interrumpe o suspende el tratamiento con ciclosporina, la dosis de Myfortic debe reevaluarse de acuerdo con el régimen inmunosupresor.
Tacrolimus
En un estudio clínico cruzado de calcineurina en pacientes con trasplante renal estable, se midió la farmacocinética en estado estacionario de Myfortic durante el tratamiento con Neoral y tacrolimus. El valor medio del AUC del ácido micofenólico fue superior al 19% (IC del 90%: - 3, +47) mientras que el valor medio del AUC del metabolito MPAG (glucurónido fenólico del ácido micofenólico) fue inferior aproximadamente al 30% ( IC del 90%: 16, 42) durante el tratamiento con tacrolimus en comparación con Neoral. Además, la variabilidad intraindividual observada en el AUC del ácido micofenólico se duplicó después de cambiar de tratamiento con Neoral a tacrolimus. Los médicos deben tener en cuenta tanto el aumento del AUC del ácido micofenólico como la variabilidad, y el ajuste de la dosis de Myfortic debe depender de la situación clínica. Se debe realizar un estrecho seguimiento clínico al planificar el cambio de un inhibidor de la calcineurina a otro.
Vacunas vivas atenuadas
No se deben administrar vacunas vivas a pacientes con respuestas inmunitarias deterioradas. La respuesta de anticuerpos a vacunas de otros tipos puede verse disminuida.
04.6 Embarazo y lactancia
Las mujeres en edad fértil
No inicie la terapia con Myfortic antes de realizar una prueba de embarazo, que debe ser negativa.
Anticoncepción en hombres y mujeres
Myfortic está contraindicado en mujeres en edad fértil que no utilizan métodos anticonceptivos de gran eficacia.
Debido al potencial genotóxico y teratogénico de Myfortic, las mujeres en edad fértil deben utilizar dos métodos anticonceptivos fiables al mismo tiempo antes de iniciar el tratamiento con Myfortic, durante el tratamiento con Myfortic y durante las seis semanas posteriores a la última dosis de Myfortic, a menos que el método anticonceptivo elegido no es abstinencia.
Se recomienda a los hombres sexualmente activos que utilicen condones durante el tratamiento con Myfortic y durante al menos 90 días después de suspender el tratamiento. El uso de condones se aplica tanto a los hombres fértiles como a los que realizan vasectomías, ya que los riesgos asociados con el paso del líquido seminal también se aplican a los hombres que se han sometido a vasectomía. . Además, se recomienda a las acompañantes de los pacientes masculinos tratados con Myfortic que utilicen métodos anticonceptivos de gran eficacia durante el tratamiento y durante un total de 90 días después de la última dosis de Myfortic.
El embarazo
Myfortic está contraindicado durante el embarazo a menos que no exista un tratamiento alternativo adecuado para prevenir el rechazo del trasplante. El tratamiento no debe iniciarse sin el resultado de una prueba de embarazo para descartar el uso inadvertido del medicamento durante el embarazo.
Se debe advertir a los pacientes masculinos y femeninos en edad fértil del aumento del riesgo de pérdida del embarazo y malformaciones congénitas al inicio del tratamiento y se les debe asesorar sobre la prevención y planificación del embarazo.
Antes de iniciar el tratamiento con Myfortic, las mujeres en edad fértil deben someterse a una prueba de embarazo para descartar la exposición involuntaria del embrión al micofenolato. Se recomiendan dos pruebas de embarazo en suero u orina con una sensibilidad de al menos 25 mUI / ml; la segunda prueba (cuando sea apropiado) debe realizarse de 8 a 10 días después de la primera e inmediatamente antes de comenzar la terapia con Myfortic. Las pruebas de embarazo deben repetirse según sea necesario clínicamente (por ejemplo, después de cada informe de interrupción de la anticoncepción). Los resultados de todas las pruebas de embarazo deben discutirse con la paciente. Se debe advertir a las pacientes que consulten a su médico inmediatamente si están embarazadas.
El micofenolato es un potente teratógeno en humanos, con un mayor riesgo de abortos espontáneos y malformaciones congénitas en caso de exposición al fármaco durante el embarazo:
• También se han informado abortos espontáneos en el 45-49% de las mujeres embarazadas expuestas al micofenolato mofetilo, en comparación con una tasa informada del 12 al 33% en pacientes con trasplante de órganos sólidos tratados con inmunosupresores distintos del micofenolato mofetilo.
• Según la literatura, se produjeron malformaciones en el 23-27% de los nacidos vivos de madres expuestas al micofenolato de mofetilo durante el embarazo (en comparación con el 2-3% de los nacidos vivos en la población general y aproximadamente el 4-5% de los nacidos vivos de sujetos sometidos a trasplante de órganos tratados con inmunosupresores distintos del micofenolato de mofetilo).
Después de la comercialización, se han observado malformaciones congénitas, incluidas notificaciones de múltiples malformaciones, en hijos de pacientes expuestas a micofenolato de mofetilo en combinación con otros inmunosupresores durante el embarazo. Las siguientes malformaciones se notificaron con mayor frecuencia:
• Anomalías del oído (por ejemplo, oído externo / medio mal formado o ausente), atresia del conducto auditivo externo;
• Enfermedad cardíaca congénita, como defectos del tabique auricular y ventricular;
• Malformaciones faciales como labio leporino, paladar hendido, micrognatia e hipertelorismo de las cuencas oculares;
• anomalías oculares (por ejemplo, coloboma);
• Malformaciones de los dedos (por ejemplo, polidactilia, sindactilia);
• Malformaciones traqueoesofágicas (p. Ej. Atresia esofágica);
• Malformaciones del sistema nervioso como espina bífida;
• Anomalías renales.
Además, ha habido informes aislados de las siguientes malformaciones:
• Microftalmia;
• Quiste congénito del plexo coroideo;
• Agenesia del septum pellucidum;
• Agenesia del nervio olfatorio.
Los estudios en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
Hora de la comida
En ratas, el ácido micofenólico se excreta en la leche materna. No se sabe si Myfortic también se excreta en la leche materna, pero como el ácido micofenólico podría causar reacciones adversas graves en el lactante, la administración de Myfortic está contraindicada durante la lactancia. 4.3).
Fertilidad
No se han realizado estudios específicos con Myfortic en humanos para evaluar sus efectos sobre la fertilidad.En un estudio de fertilidad en machos y hembras en ratas, no se observaron efectos hasta dosis de 40 mg / kg y 20 mg / kg, respectivamente (ver sección 5.3 ).
04.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre los efectos sobre la capacidad para conducir y utilizar máquinas. El mecanismo de acción, el perfil farmacodinámico y las reacciones adversas notificadas hacen que tal efecto sea poco probable.
04.8 Efectos indeseables
Las siguientes reacciones adversas se refieren a reacciones adversas a medicamentos observadas en estudios clínicos.
Neoplasias
Los pacientes que reciben terapia inmunosupresora consistente en una combinación de fármacos, incluido ácido micofenólico, tienen un mayor riesgo de desarrollar linfomas u otras neoplasias malignas, especialmente de la piel (ver sección 4.4). Se ha desarrollado una enfermedad linfoproliferativa o linfoma en 2 pacientes. de-novo (0,9%) y en 2 pacientes de mantenimiento (1,3%) que tomaron Myfortic durante un año. En el 0,9% de los pacientes de-novo y el 1,8% de los pacientes de mantenimiento que tomaron Myfortic durante un año tenían cáncer de piel no melanoma; se observaron otros tipos de cáncer en el 0,5% de los pacientes de-novo y en el 0,6% de los pacientes en fase de mantenimiento.
Infecciones oportunistas
El riesgo de infecciones oportunistas aumenta en todos los pacientes trasplantados, el riesgo aumenta con la carga inmunosupresora total (ver sección 4.4). Las infecciones oportunistas más frecuentes en pacientes con trasplante renal de-novo tratados con Myfortic en combinación con otros inmunosupresores observados en ensayos clínicos controlados de pacientes con trasplante renal seguidos durante 1 año fueron CMV (citomegalovirus), candidiasis y herpes simple. Las infecciones por CMV (serología, viremia o enfermedad establecida) fueron del 21,6% en pacientes con trasplante renal de novo y 1,9% en pacientes con terapia de mantenimiento.
Personas mayores
En general, los pacientes de edad avanzada pueden tener un mayor riesgo de desarrollar reacciones adversas debido a la inmunosupresión.
Otras reacciones adversas a medicamentos
La siguiente tabla 1 enumera las reacciones adversas posiblemente o probablemente relacionadas con Myfortic, notificadas en ensayos clínicos controlados en pacientes con trasplante de riñón en los que Myfortic se administró en combinación con microemulsión de ciclosporina y corticosteroides a una dosis de 1440 mg / día durante 12 meses. se compiló de acuerdo con la clasificación de clasificación de órganos del sistema MedDRA.
Las reacciones adversas se enumeran de acuerdo con las siguientes categorías:
Muy frecuentes (≥ 1/10)
Común (> 1/100,
Poco frecuentes (> 1 / 1.000,
Raras (> 1 / 10,000,
Muy raro (
tabla 1
* evento notificado en un solo paciente (de 372).
Nota: Los pacientes con trasplante de riñón fueron tratados con Myfortic 1440 mg / día hasta por un año. El perfil de reacciones adversas es similar en los pacientes. de-novo y en la población en terapia de mantenimiento después del trasplante, incluso si la incidencia de reacciones adversas parece ser menor en esta última población.
A partir de la experiencia postcomercialización, se han identificado erupciones cutáneas y agranulocitosis como reacciones adversas.
Las siguientes reacciones adversas adicionales se han atribuido como efecto de clase a los derivados del ácido micofenólico:
Infecciones e infestaciones.:
Infecciones graves que ponen en peligro la vida, como meningitis, endocarditis infecciosa, tuberculosis e infección micobacteriana atípica. Se han notificado casos de nefropatía asociada al virus BK, así como casos de leucoencefalopatía multifocal progresiva (LMP) asociada al virus JC, en pacientes tratados con inmunosupresores, incluido Myfortic (ver sección 4.4).
Trastornos del sistema sanguíneo y linfático:
Neutropenia, pancitopenia.
Se han notificado casos de aplasia pura de glóbulos rojos (PRCA) en pacientes tratados con derivados del ácido micofenólico (ver sección 4.4).
Trastornos del sistema inmunológico.
Se ha notificado hipogammaglobulinemia en pacientes que reciben Myfortic en combinación con otros inmunosupresores.
Trastornos respiratorios, torácicos y mediastínicos:
Se han notificado casos aislados de enfermedad pulmonar intersticial en pacientes tratados con Myfortic en combinación con otros inmunosupresores. También ha habido informes de bronquiectasias en combinación con otros inmunosupresores.
Se han notificado casos aislados de anomalías morfológicas de los neutrófilos, incluida la anomalía de Pelger-Huet adquirida, en pacientes tratados con derivados del ácido micofenólico. Sin embargo, estas alteraciones no están asociadas con la funcionalidad deficiente de los neutrófilos. Estas alteraciones pueden sugerir un fenómeno de Shift izquierdo maduración de los neutrófilos, que puede malinterpretarse como un signo de infección en pacientes inmunosuprimidos, como los tratados con Myfortic.
Desórdenes gastrointestinales:
Colitis, gastritis por CMV, perforación intestinal, úlcera gástrica, úlcera duodenal.
Embarazo, puerperio y afecciones perinatales:
Se han notificado casos de aborto espontáneo en pacientes expuestas al micofenolato principalmente en el primer trimestre (ver sección 4.6).
Trastornos congénitos:
Después de la comercialización, se han observado malformaciones congénitas en hijos de pacientes expuestos a micofenolato en combinación con otros inmunosupresores (ver sección 4.6).
Notificación de sospechas de reacciones adversas
La notificación de sospechas de reacciones adversas que se produzcan después de la autorización del medicamento es importante, ya que permite un seguimiento continuo de la relación beneficio / riesgo del medicamento. Se ruega a los profesionales sanitarios que notifiquen cualquier sospecha de reacciones adversas a través del sistema nacional de notificación. "Dirección www. agenziafarmaco.gov.it/it/responsabili.
04.9 Sobredosis
Ha habido informes de sobredosis intencionales o accidentales con Myfortic, aunque no todos los pacientes han experimentado efectos adversos relacionados.
En aquellos casos de sobredosis para los que se han notificado reacciones adversas, las reacciones entran dentro del alcance del perfil de seguridad conocido de la clase (principalmente discrasias sanguíneas, sepsis ...) (ver secciones 4.4 y 4.8).
Aunque la diálisis se puede utilizar para eliminar el metabolito inactivo del ácido micofenólico MPAG, no se espera que elimine cantidades clínicamente significativas de la parte activa del ácido micofenólico, debido principalmente a la alta unión del ácido micofenólico a las proteínas plasmáticas. medicamentos como la colestiramina, al interferir con la circulación enterohepática del ácido micofenólico, pueden disminuir la exposición sistémica al ácido micofenólico.
05.0 PROPIEDADES FARMACOLÓGICAS
05.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: inmunosupresores.
Código ATC: L04 AA06.
El ácido micofenólico es un inhibidor potente, selectivo, no competitivo y reversible de la enzima inosina monofosfato deshidrogenasa; inhibe la vía de síntesis de-novo del nucleótido guanosina, sin incorporarse al ADN. La proliferación de linfocitos T y B es críticamente dependiente de la síntesis. de-novo de las purinas, a diferencia de otros tipos de células que pueden utilizar un mecanismo alternativo, la acción citostática del ácido micofenólico sobre los linfocitos es más potente que la ejercida sobre otros tipos de células.
05.2 Propiedades farmacocinéticas
Absorción
Después de la administración oral, el micofenolato de sodio se absorbe ampliamente. De acuerdo con las características de la formulación gastroentérica, el Tmax (tiempo para alcanzar la concentración máxima) del ácido micofenólico es de aproximadamente 1,5 a 2 horas. Aproximadamente el 10% de los perfiles farmacocinéticos determinados después de la administración matutina mostraron una prolongación del valor de Tmax, algunas veces de varias horas, sin ninguna influencia estimada sobre la exposición al ácido micofenólico en las 24 horas.
En pacientes con trasplante renal estable que recibieron tratamiento inmunosupresor con ciclosporina, la absorción gastrointestinal del ácido micofenólico fue del 93% y la biodisponibilidad absoluta fue del 72%. La farmacocinética de Myfortic fue proporcional a la dosis y lineal en el rango de dosis probado (180 - 2160 mg). La administración de una dosis única de Myfortic (720 mg) con alimentos ricos en grasas (55 g de grasa, 1000 calorías) no modificó el AUC (el parámetro farmacocinético importante correlacionado con la eficacia) del ácido micofenólico en comparación con la administración del fármaco en ayunas; sin embargo, la Cmax del ácido micofenólico se redujo en un 33%. Además, se observó una prolongación media de los valores de tlag y Tmax de 3-5 horas, con valores de Tmax> 15 horas en muchos pacientes. "La ingesta de alimentos sobre la farmacocinética de Myfortic por lo tanto, puede provocar una superposición en la absorción de un rango de dosis a otro ". Sin embargo, este efecto no mostró ninguna importancia clínica.
Distribución
El volumen de distribución en estado estacionario del ácido micofenólico es de 50 L. Tanto el ácido micofenólico como su metabolito glucuronato están fuertemente unidos a las proteínas plasmáticas (97% y 82%, respectivamente). La concentración de ácido micofenólico libre puede aumentar en condiciones que conducen a una disminución de los sitios de unión a proteínas (uremia, insuficiencia hepática, hipoalbuminemia, uso concomitante de fármacos de alta unión a proteínas plasmáticas). Esto puede conducir a un mayor riesgo de eventos adversos relacionados con el ácido micofenólico.
Biotransformación
El ácido micofenólico es metabolizado por la enzima glucuroniltransferasa en glucurónido fenólico del ácido micofenólico (MPAG). El MPAG es el principal metabolito del ácido micofenólico y no tiene actividad biológica. En pacientes estables que reciben ciclosporina después de un trasplante de riñón, aproximadamente el 28% de la dosis de Myfortic administrada por vía oral se metaboliza a MPAG por metabolismo presistémico. La vida media de este metabolito, más prolongada que la del ácido micofenólico, es de unas 16 horas y su aclaramiento es de 0,45 L / h.
Eliminación
La vida media del ácido micofenólico es de aproximadamente 12 horas y el aclaramiento es de 8,6 l / hora. Aunque hay cantidades insignificantes de ácido micofenólico en la orina (la bilis está disponible para la desconjugación por la flora intestinal y el ácido micofenólico que se forma a través de este proceso puede reabsorberse. Aproximadamente 6-8 horas después de la administración de Myfortic es posible de hecho observaron un segundo pico de concentración de ácido micofenólico, correlacionado con la reabsorción del ácido micofenólico desconjugado. / ml) se observaron por la mañana en aproximadamente el 2% de los pacientes tratados con Myfortic. Sin embargo, durante los estudios, el AUC en estado estacionario (0-12 h) que es indicativo de exposición global, mostró menos variabilidad que la de la concentración plasmática mínima (Ctrough).
Farmacocinética en pacientes con trasplante renal que reciben tratamiento inmunosupresor con ciclosporina:
La siguiente tabla 2 muestra los parámetros farmacocinéticos medios del ácido micofenólico después de la administración de Myfortic En el período inmediatamente posterior al trasplante, los valores medios de AUC y Cmax del ácido micofenólico fueron aproximadamente la mitad de los valores determinados seis meses después del trasplante. .
Tabla 2 Parámetros farmacocinéticos (media y DE) relacionados con el MPA tras la administración oral de Myfortic en pacientes con trasplante renal que reciben inmunosupresión con ciclosporina.
(* valores medianos)
Insuficiencia renal
La farmacocinética del ácido micofenólico parece no cambiar desde la etapa de función renal normal hasta la insuficiencia renal. Por el contrario, la exposición al metabolito MPAG aumenta con la función renal disminuida, y es aproximadamente 8 veces mayor en presencia de anuria. El aclaramiento del ácido micofenólico y el del metabolito MPAG no se vieron afectados por la "hemodiálisis. L" El ácido micofenólico libre también puede aumenta significativamente en condiciones de insuficiencia renal, probablemente debido a una disminución en la unión del ácido micofenólico a las proteínas plasmáticas en presencia de concentraciones sanguíneas elevadas de urea.
Deterioro hepático
La glucuronidación hepática del ácido micofenólico se ve escasamente alterada por la presencia de patologías del parénquima hepático, como se observa en voluntarios con cirrosis alcohólica. Los efectos de la enfermedad hepática sobre el metabolismo de los fármacos probablemente dependan del tipo de patología: una enfermedad hepática con daño predominante en las vías biliares, como la cirrosis biliar primaria, pueden tener un efecto diferente sobre el metabolismo del ácido micofenólico.
Población pediátrica y adolescente
Se dispone de datos limitados sobre el uso de Myfortic en niños y adolescentes.La Tabla 2 anterior describe los parámetros farmacocinéticos medios (DE) del ácido micofenólico en pacientes pediátricos estables con trasplante renal de 5-16 años sometidos a tratamiento inmunosupresor con ciclosporina. El AUC medio de ácido micofenólico a una dosis de 450 mg / m2 fue similar al AUC determinado en adultos tratados con Myfortic a una dosis de 720 mg. El aclaramiento medio aparente de ácido micofenólico fue de aproximadamente 6,7 L / h / m2.
Escribe
No existen diferencias de género clínicamente significativas en la farmacocinética de Myfortic.
Personas mayores
La farmacocinética en los ancianos no se ha evaluado en estudios apropiados. La exposición al ácido micofenólico no parece variar significativamente con la edad.
05.3 Datos preclínicos sobre seguridad
En estudios de toxicidad a dosis repetidas realizados con micofenolato de sodio en ratas y ratones, los principales órganos afectados fueron los sistemas hematopoyético y linfoide. La anemia aplásica regenerativa se identificó como una expresión de toxicidad limitante de la dosis en roedores expuestos a MPA. La evaluación de los mielogramas mostró una disminución marcada de las células eritroides (normoblastos y eritroblastos policromáticos), una hipertrofia esplénica "dependiente de la dosis" y un aumento de hematopoyesis medular Estos efectos se produjeron a niveles de exposición sistémica equivalentes o inferiores a los observados en el entorno clínico en pacientes con trasplante renal con la dosis recomendada de Myfortic de 1,44 g / día.
Se observaron efectos gastrointestinales en perros a niveles de exposición sistémica equivalentes o inferiores a los observados en el entorno clínico con la dosis recomendada.
Por tanto, el perfil toxicológico del ácido micofenólico (como sal sódica) resultante de los estudios preclínicos concuerda con los efectos adversos observados en los estudios clínicos, que proporcionan datos de seguridad de mayor relevancia para la población de pacientes (ver sección 4.8).
En tres pruebas de genotoxicidad (ensayo de linfoma de ratón in vitro, micronúcleos de células V79 de hámster chino y ensayo de micronúcleos de médula ósea de ratón in vivo), el ácido micofenólico mostró el potencial de causar aberraciones cromosómicas. Es posible que los efectos observados estén relacionados con el mecanismo farmacodinámico de acción, es decir, la inhibición de la síntesis de nucleótidos en células sensibles En otras pruebas in vitro destinadas a evaluar la inducción de mutaciones genéticas, el ácido micofenólico no mostró actividad genotóxica.
El ácido micofenólico (como sal sódica) no fue carcinogénico en ratas y ratones. En estudios de carcinogenicidad en animales, la dosis máxima probada corresponde a una exposición sistémica (AUC o Cmax) de aproximadamente 0,6 - 5 veces la observada en pacientes con trasplante renal tratados con la dosis recomendada. de Myfortic de 1,44 g / día.
El ácido micofenólico (como sal sódica), incluso en dosis que han causado toxicidad general y embriotoxicidad, no tiene ningún efecto sobre la fertilidad de ratas machos y hembras.
En un estudio de teratogénesis en ratas con ácido micofenólico (como sal sódica) a una dosis de 1 mg / kg, se observaron malformaciones en la progenie, incluyendo anoftalmia, exencefalia y hernia umbilical. La exposición sistémica correspondiente a esta dosis es igual a 0,05 veces la exposición clínica con la dosis de Myfortic de 1,44 mg / día (ver sección 4.6).
En un estudio de desarrollo pre y postnatal en ratas, el ácido micofenólico (como sal sódica) provocó retrasos en el desarrollo (reflejo pupilar anormal en la hembra y separación del prepucio en el macho) a la dosis máxima de 3 mg / kg que también induce malformaciones.
En un ensayo in vitro de fototoxicidad El ácido micofenólico 3T3 NRU (como sal sódica) mostró potencial fototóxico.
06.0 INFORMACIÓN FARMACÉUTICA
06.1 Excipientes
Núcleo:
Maicena
Povidona (K 30)
Crospovidona
Lactosa anhidra
Sílice coloidal anhidra
Estearato de magnesio.
Revestimiento:
Ftalato de hipromelosa
Dióxido de titanio (E171)
Óxido de hierro amarillo (E172)
Carmín índigo (E132)
06.2 Incompatibilidad
Irrelevante.
06.3 Período de validez
30 meses.
06.4 Precauciones especiales de conservación
No conservar por encima de 30 ° C.
Almacenar en el paquete original para protegerlo de la humedad.
06.5 Naturaleza del envase primario y contenido del envase.
Los comprimidos se envasan en blísteres de poliamida / aluminio / PVC / aluminio, cada uno con 10 comprimidos, en cantidades por caja de 20, 50, 100, 120 y 250 comprimidos.
Es posible que no se comercialicen todos los tamaños de envases.
06.6 Instrucciones de uso y manipulación
Para mantener intacto el recubrimiento entérico, los comprimidos de Myfortic no deben triturarse (ver sección 4.2).
El ácido micofenólico ha mostrado efectos teratogénicos (ver sección 4.6).
Si es necesario triturar las tabletas de Myfortic, evite la inhalación o el contacto directo del polvo con la piel o las membranas mucosas.
Los medicamentos no utilizados y los desechos derivados de este medicamento deben eliminarse de acuerdo con las regulaciones locales.
07.0 TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Farma S.p.A
Largo Umberto Boccioni, 1
Origgio (Va)
08.0 NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
180 mg comprimidos gastrorresistentes - 20 comprimidos AIC n.: 036511018
180 mg comprimidos gastrorresistentes - 50 comprimidos AIC n.: 036511020
180 mg comprimidos gastrorresistentes - 100 comprimidos n. ° AIC: 036511032
180 mg comprimidos gastrorresistentes - 120 comprimidos n. ° AIC: 036511044
180 mg comprimidos gastrorresistentes - 250 comprimidos AIC n.: 036511057
09.0 FECHA DE LA PRIMERA AUTORIZACIÓN O RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 13 de junio de 2005
Fecha de renovación: 10 de octubre de 2008
10.0 FECHA DE REVISIÓN DEL TEXTO
07/2016